好代码学习|樊嘉院士最新的Cancer Cell非单细胞的多组学生信学习
- 2026-01-23 15:46:50
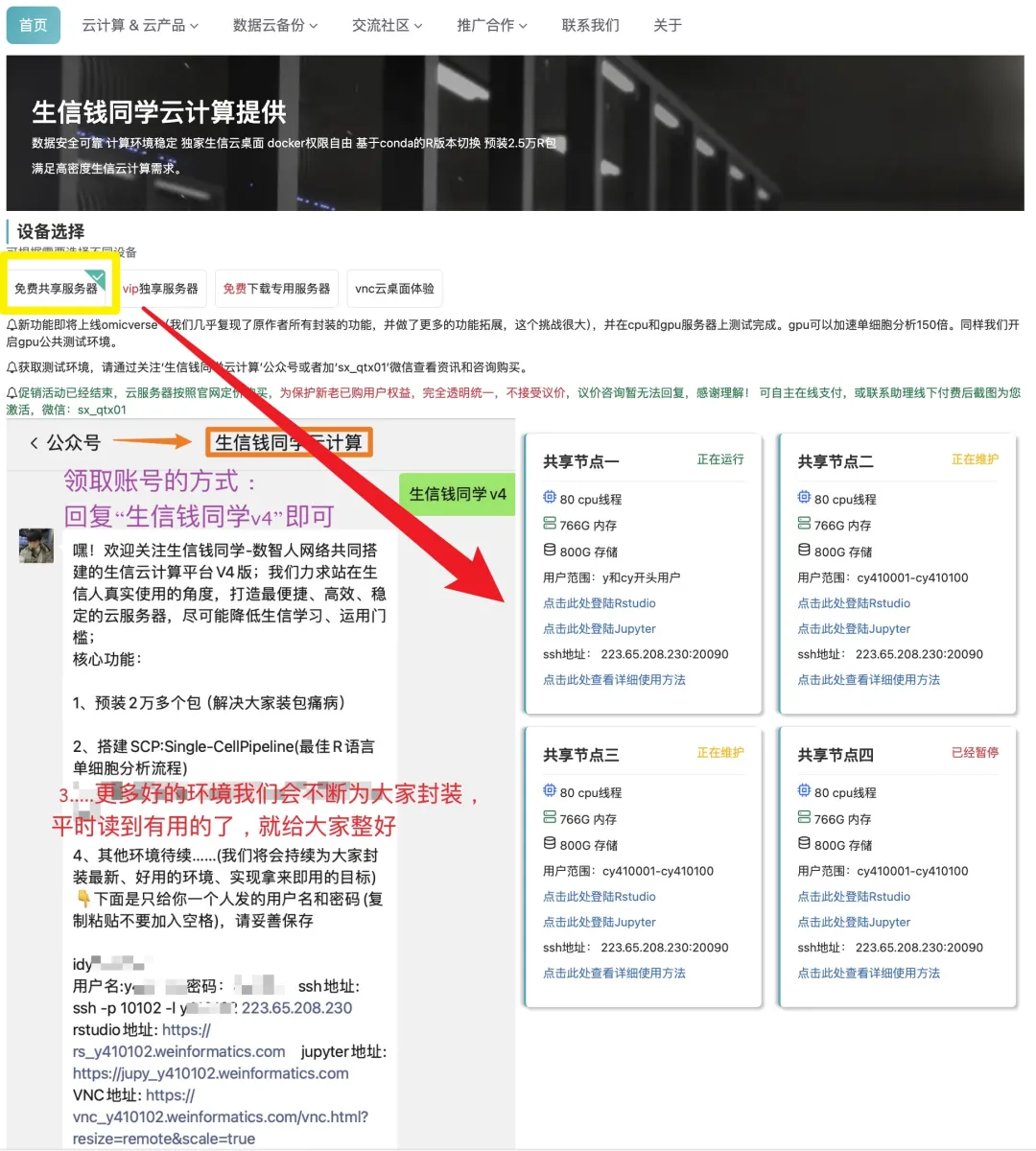
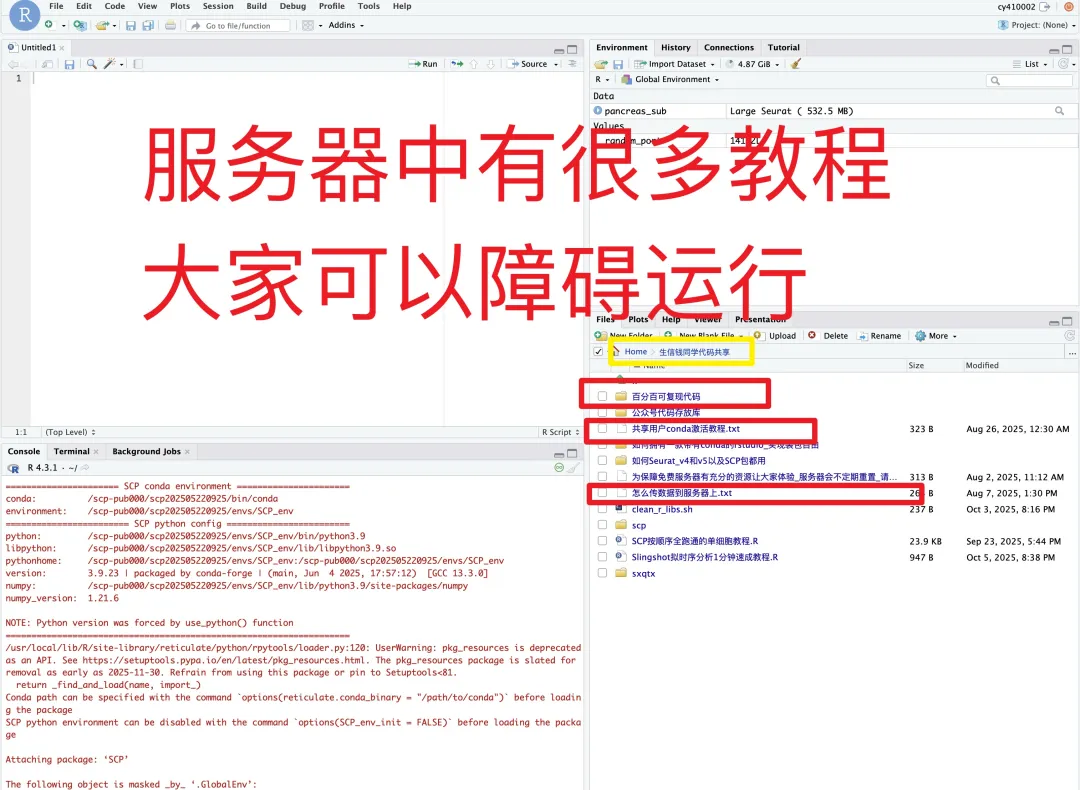
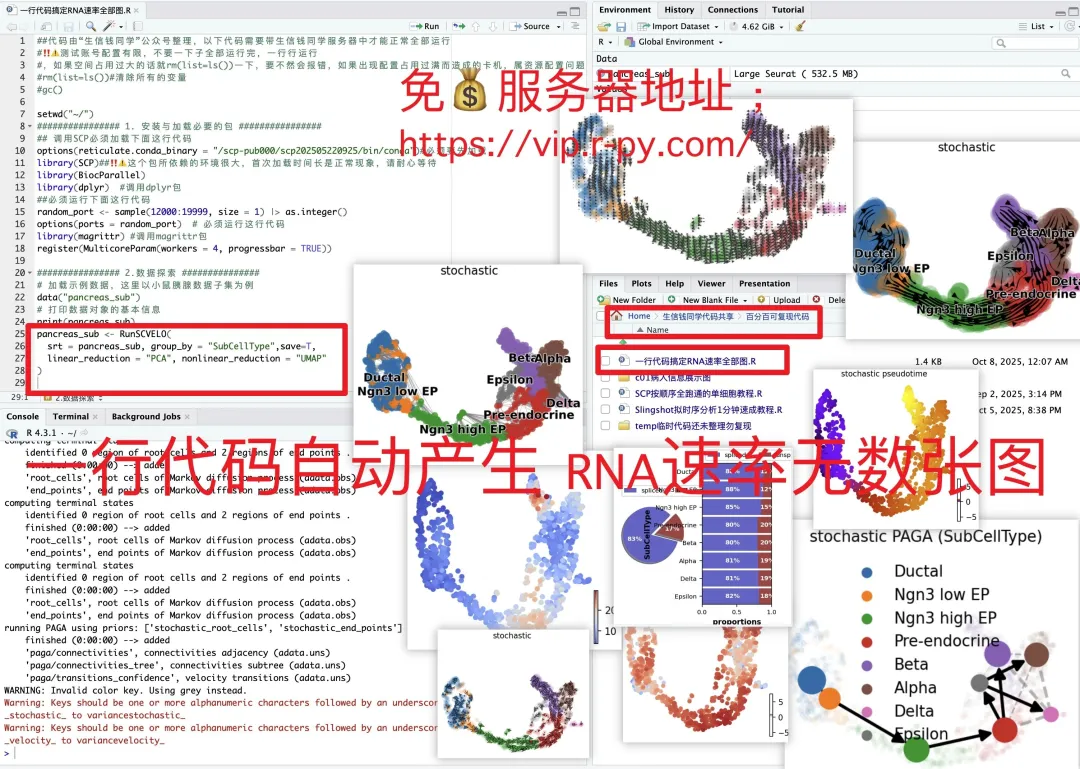
日常好的代码已放入免💰共享服务器中(人人皆可用):https://vip.r-py.com/
中国团队破解胆囊癌分子密码 为精准治疗提供新靶点
近日,复旦大学附属中山医院樊嘉院士教授团队联合国内多家科研机构,在国际顶级期刊《Cancer Cell》发表重磅研究成果。该团队通过对 195 例胆囊癌患者样本进行整合蛋白质基因组学分析,首次绘制出胆囊癌的分子特征全景图,发现多个潜在治疗靶点和分子分型体系,为这一恶性肿瘤的精准治疗开辟新路径。
胆囊癌作为胆道系统最常见的恶性肿瘤,具有极高的侵袭性和死亡率。2022 年全球新发病例超 12 万,死亡近 9 万,晚期患者 5 年生存率不足 10%。由于缺乏有效的分子标志物和靶向药物,临床治疗长期依赖传统化疗,疗效有限。此次研究正是针对这一临床痛点,通过多组学技术深入解析胆囊癌的分子机制。
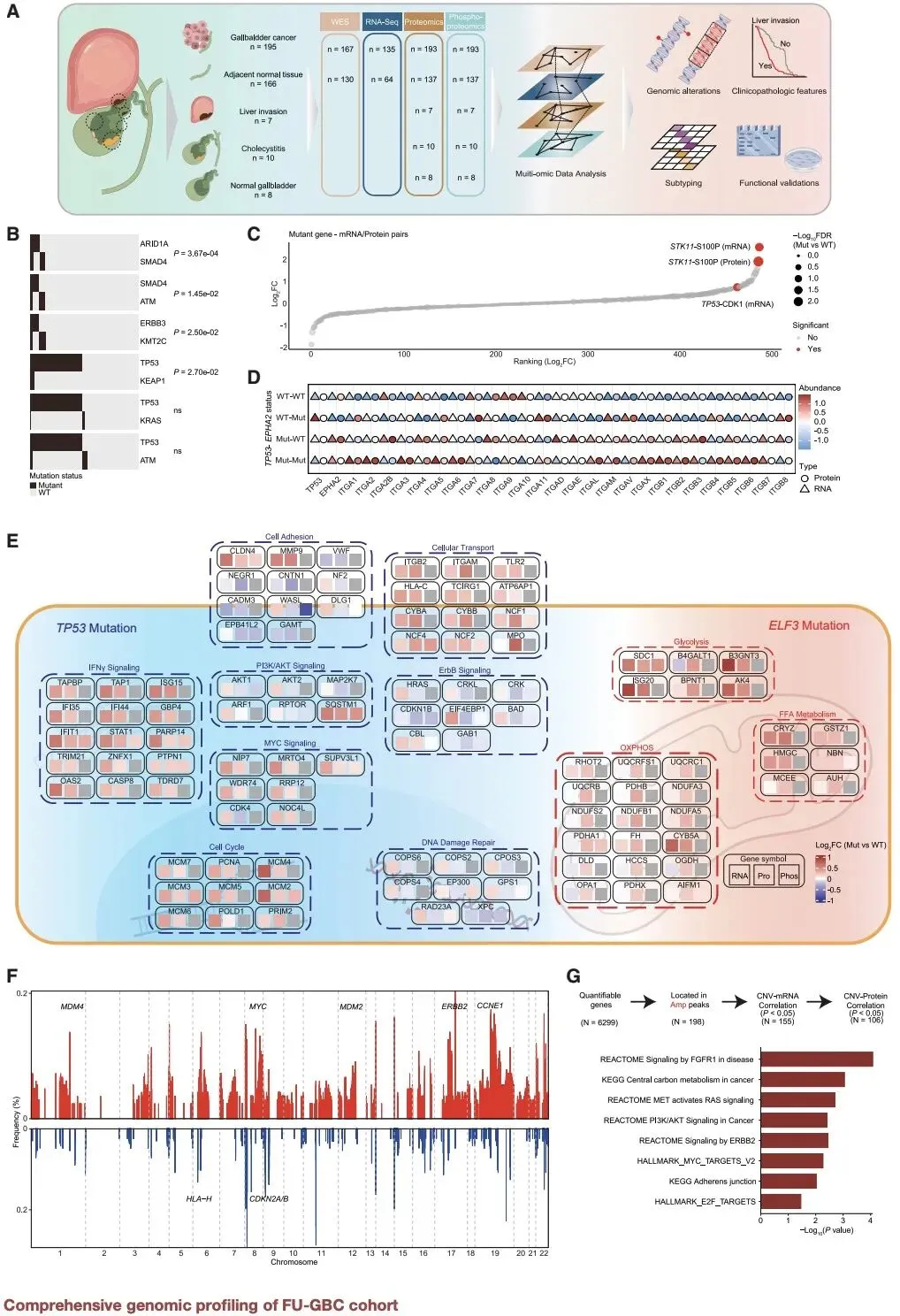
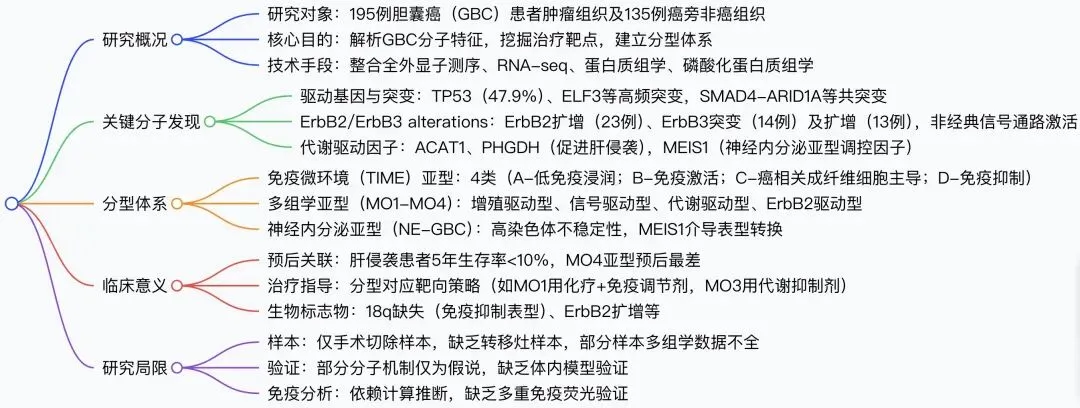
研究团队采用全外显子测序、RNA 测序、蛋白质组学和磷酸化蛋白质组学等多种技术,对 195 例胆囊癌组织和 135 例癌旁正常组织进行系统分析,鉴定出 47.9% 的患者存在 TP53 基因突变,9.0% 存在 ELF3 基因突变,这些突变通过扰乱信号传导和代谢过程驱动肿瘤发生。尤为重要的是,研究发现 ErbB2/ErbB3 基因改变在胆囊癌中发挥关键作用,ErbB2 扩增通过非经典信号通路促进肿瘤增殖,而 ErbB3 的 P306R 等突变则增强其与 ErbB2 的异源二聚体活性,为靶向治疗提供了新的作用位点。
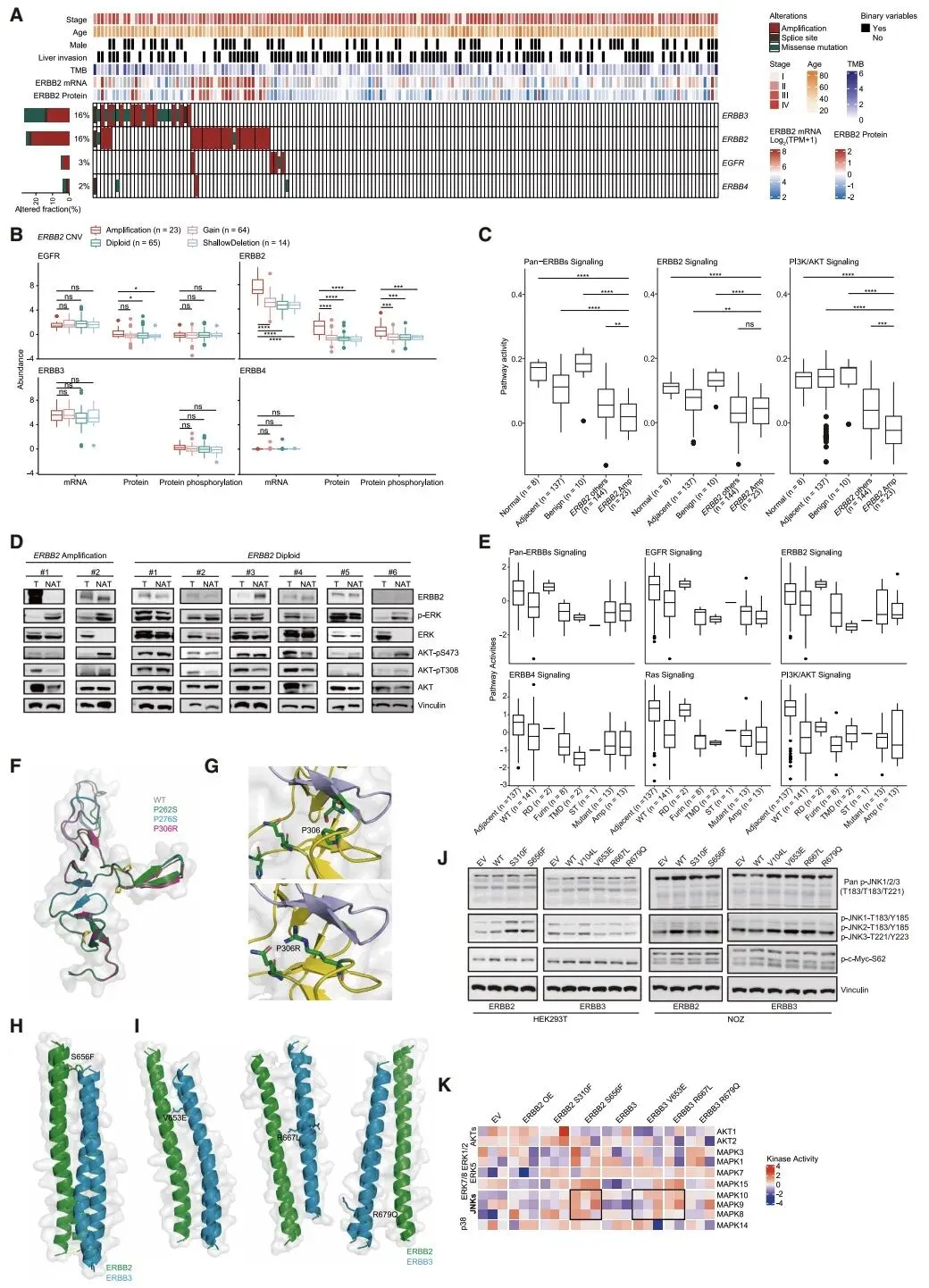
针对胆囊癌最致命的特征 —— 肝侵袭,研究团队发现代谢重编程是其核心驱动机制。ACAT1 和 PHGDH 两种代谢酶在肝侵袭灶中持续高表达,敲低这两种蛋白可显著抑制肿瘤细胞的增殖和侵袭能力,为阻断胆囊癌转移提供了新的代谢靶点。
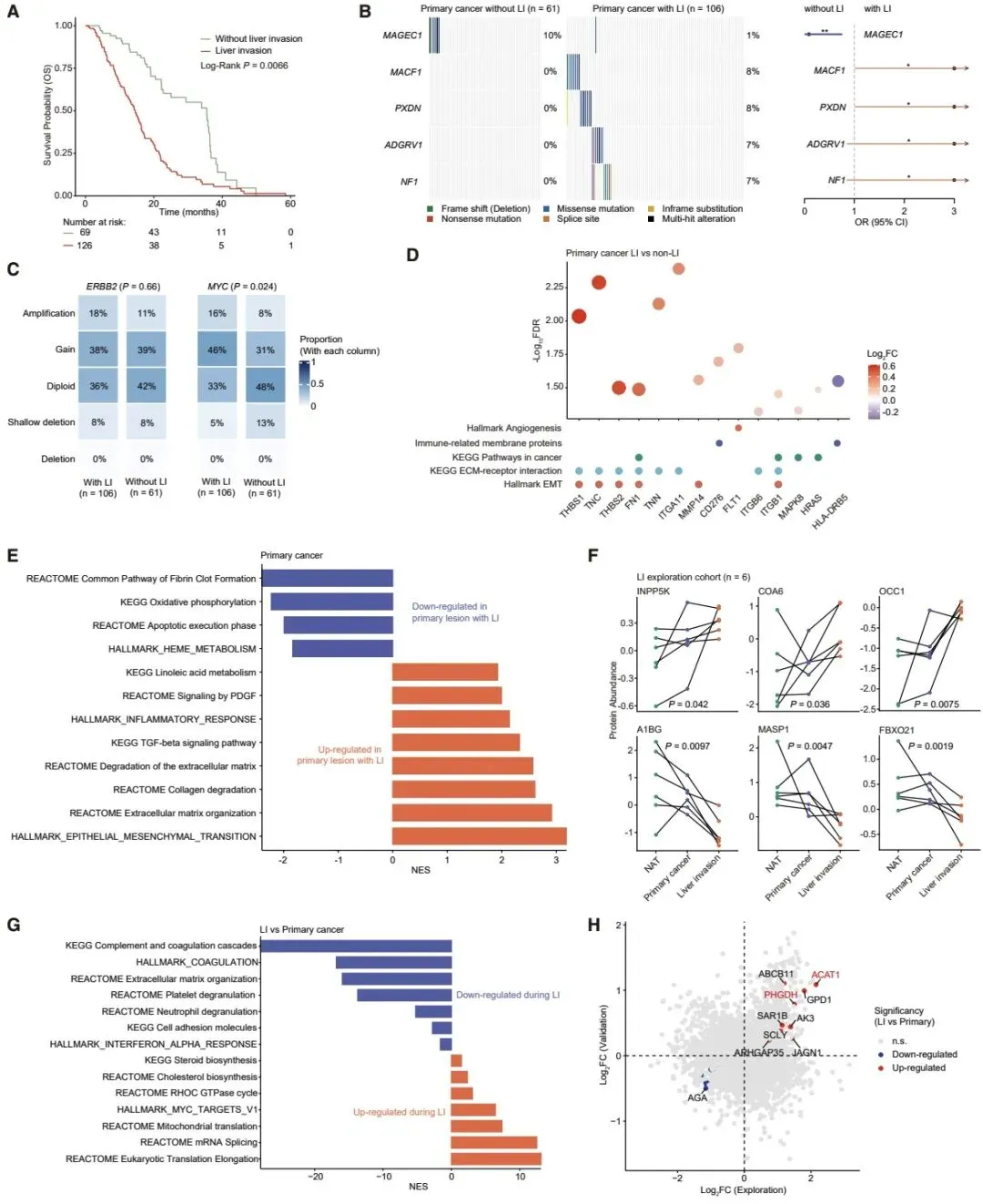
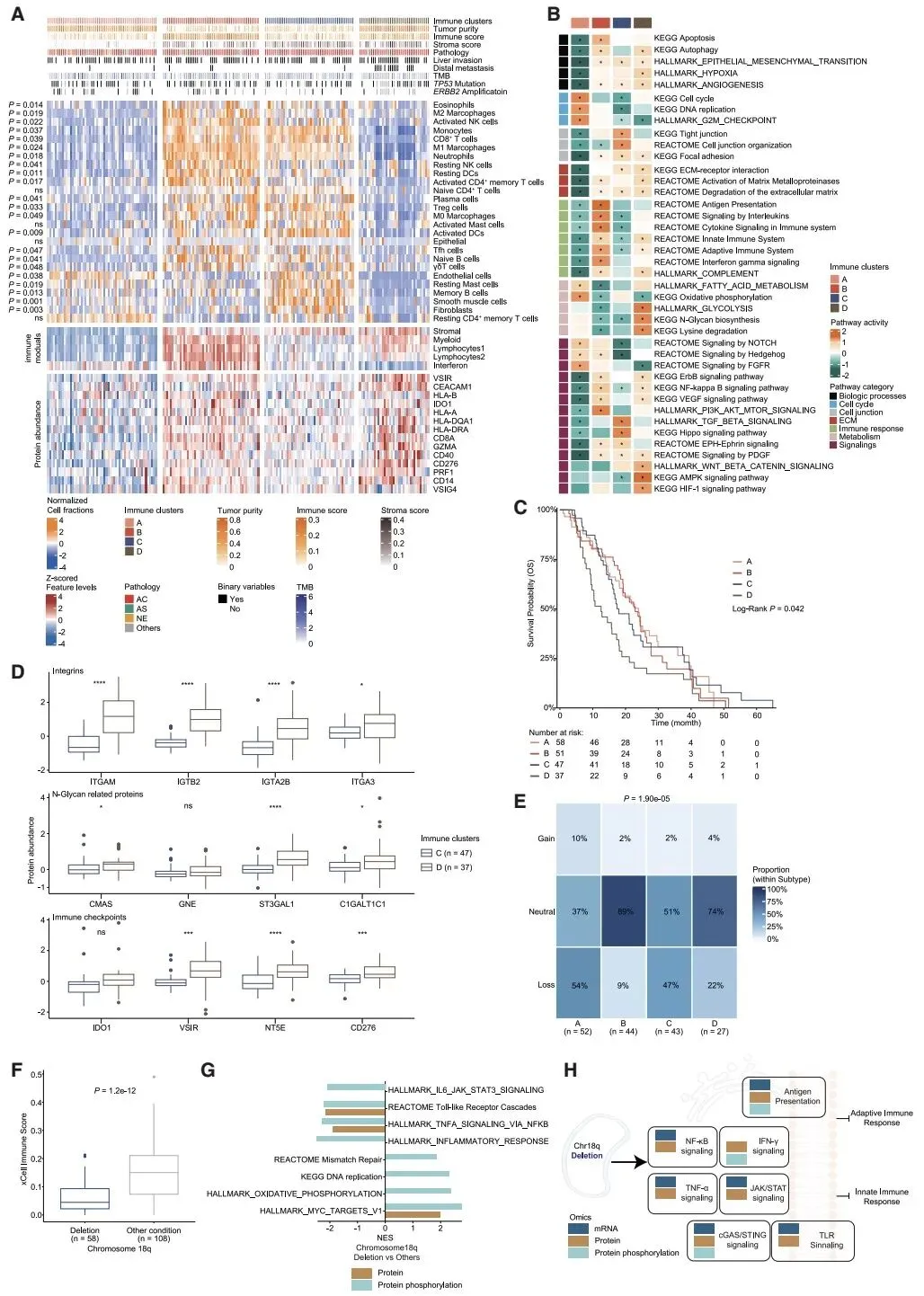
在分子分型方面,研究创新性地建立了两种临床相关的分型体系。免疫微环境分型将胆囊癌分为四种亚型,其中 18 号染色体长臂缺失与免疫抑制表型密切相关,可作为免疫治疗疗效的预测标志物;多组学分型则识别出增殖驱动型、信号驱动型、代谢驱动型和 ErbB2 驱动型四种亚型,不同亚型对应不同的治疗 vulnerabilities,如代谢驱动型对线粒体抑制剂敏感,ErbB2 驱动型可响应 ErbB2 靶向治疗联合免疫检查点抑制剂。
对于占比 2%-5% 的罕见亚型 —— 神经内分泌胆囊癌,研究首次揭示 MEIS1 基因是其关键调控因子。MEIS1 通过与 MYC 协同作用,诱导腺癌细胞向神经内分泌表型转化,这一发现为这类难治性肿瘤提供了潜在的干预靶点。
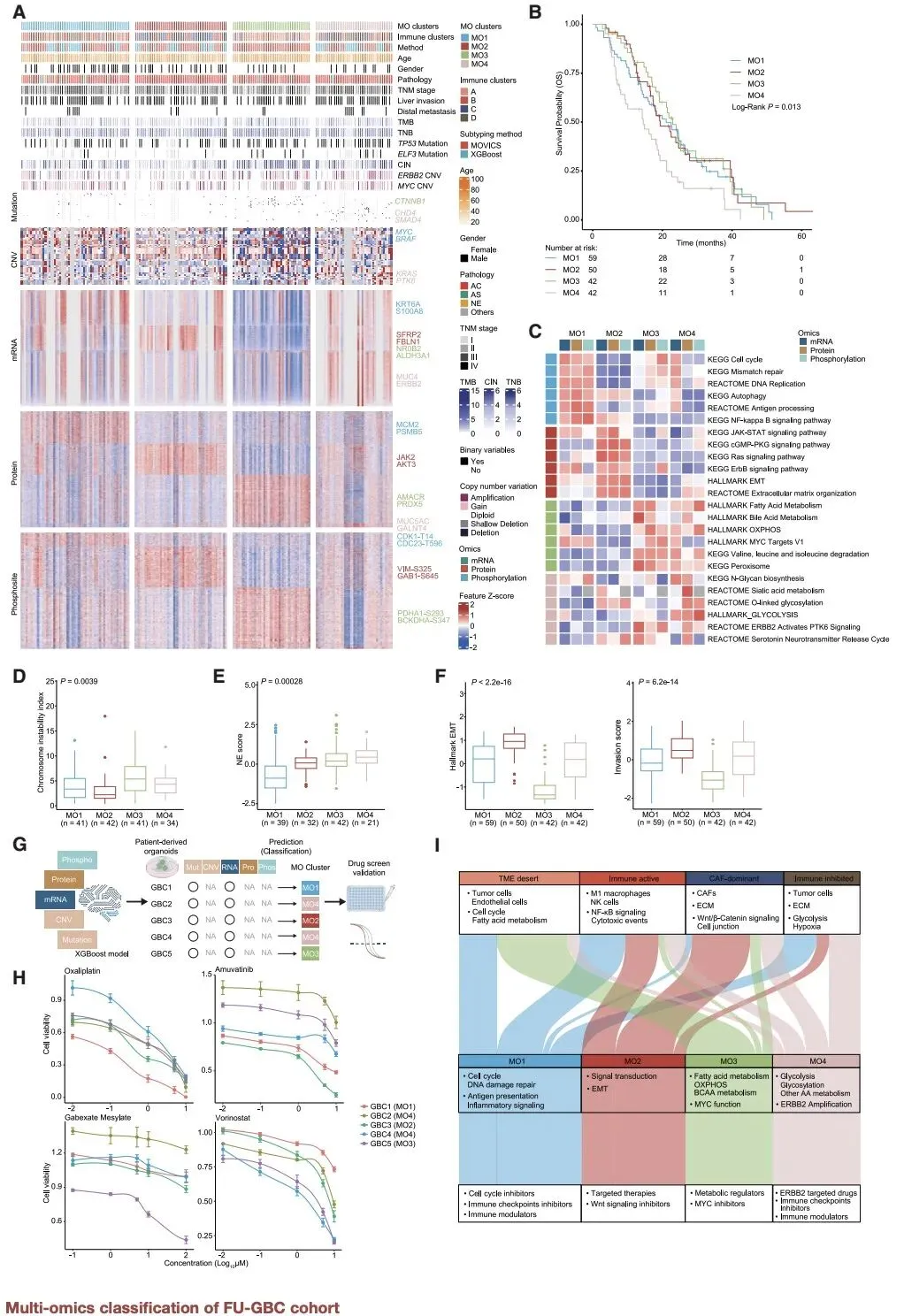
该研究还构建了开放的胆囊癌蛋白质基因组学数据库,包含 16393 个蛋白编码 mRNA、7114 种蛋白质和 6056 个磷酸化位点的表达数据,为全球科研人员提供了宝贵的研究资源。研究成果已在患者来源的类器官模型中得到验证,显示基于分子分型的治疗策略可显著提高治疗响应率。
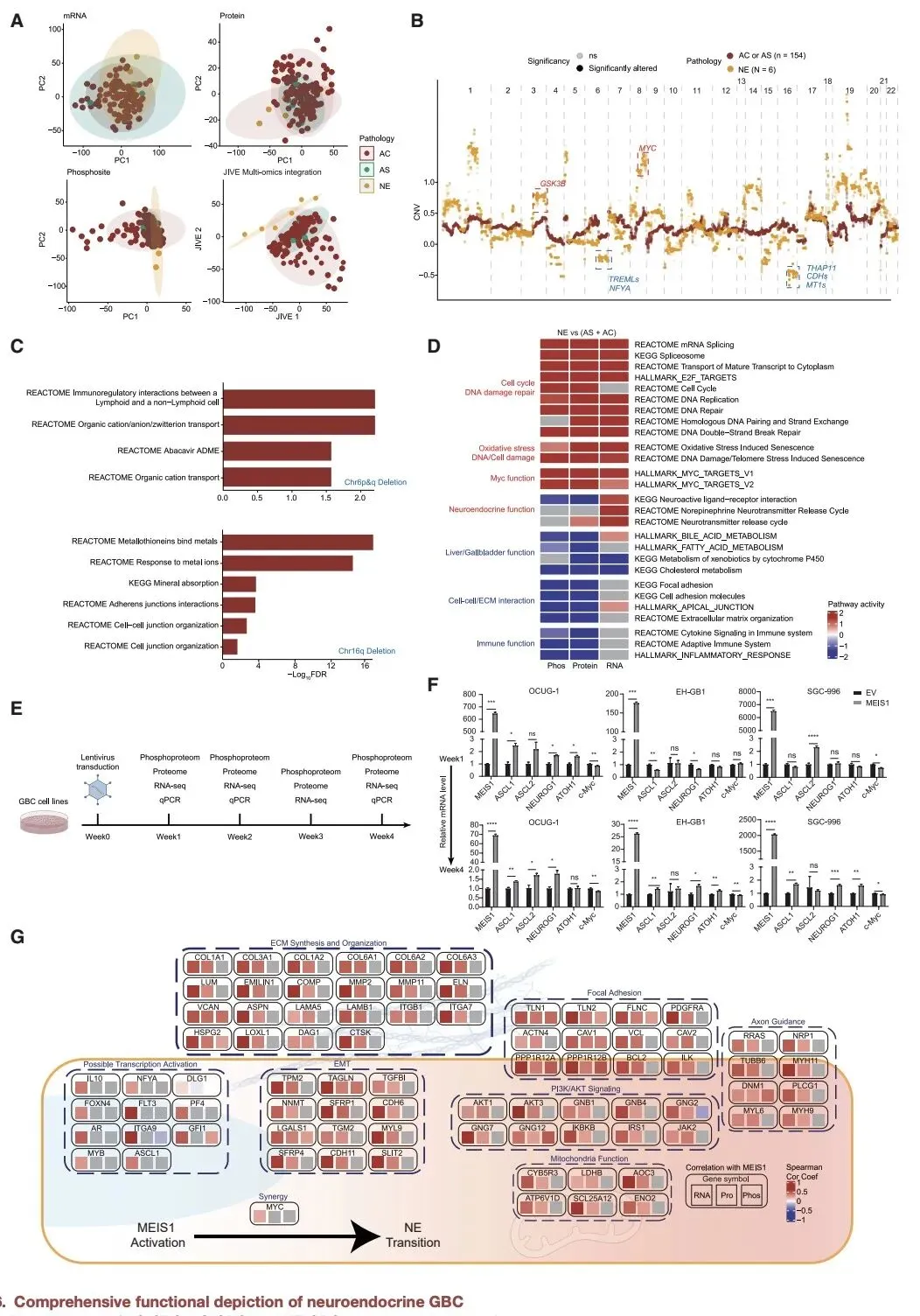
这项研究通过整合多组学技术,系统解析了胆囊癌的分子特征和发病机制,发现的多个潜在靶点和分型体系为临床精准治疗提供了科学依据。下一步团队将推进临床试验,将这些基础研究成果转化为临床可用的诊断试剂盒和治疗方案,有望显著改善胆囊癌患者的预后。
(我们自己开发的服务器,很多意想不到的功能
免💰服务器地址:https://vip.r-py.com/)
生信钱同学团队提供生信便捷式“云服务器”、“数据分析”、“生信学习班”以及“生信交流群”等内容,有需要者可以加我:sx_qtx01
相关推文内容:
今天开课了,没服务器直接送——多组学与机器学习联合分析(机器学习分析代谢组、蛋白组、宏基因组、网络药理学、转录组课)
学生信当然要与时俱进了,零基础也能学的AI生信课(AI助力生信入门班即将开始(AI课)
超多生信内容学习,感兴趣可以了解下(单细胞课程)
没有服务器,单细胞数据搞不定?看看我们做出来的结果包含啥?我们目前做好了这些pipeline,可以帮你做(数据分析) 公共共享服务器已开启,无门槛尽管用,不限制资源(免💰服务器) 今晚 7 点开始,12节线上课,不收费,把开源的QuPath病理和荧光图像分析的技巧学明白 手把手复现Nature的生信教学即将开始,感兴趣的可以了解下 当我同学用这个套路发了10几篇SCI,并拿了国奖,我惊呆了——文献计量学+AI大语言模型学习(文献计量培训) Gemini详细安装教程,自动分析数据,不是器械式写代码,而是帮你做好,就是这么智能(AI自动写代码,自动分析数据)

Integrative proteogenomic analysis provides molecular insights and clinical significance in gallbladder cancer, Cancer cell 2526
