蛋白编程的抗癌新技术——海淀期末原始文献解读
- 2026-02-06 08:33:41


基于识别靶点的剪接调控激活技术
——细胞表面逻辑门控蛋白执行器
癌症治疗最头疼的问题是什么?不是找不到癌细胞,而是认不准癌细胞。想象一下,如果我们要在拥挤的人群中找出几个穿着特定衣服的人,但这些人穿的衣服和普通市民差不多,只是颜色组合略有不同,这该有多难?传统的抗癌药物就像"见人就打"的莽夫,虽然能杀伤癌细胞,但也会误伤正常细胞,导致患者脱发、恶心、免疫力下降等严重副作用。
有没有一种方法,能让药物像精明的侦探一样,通过多重身份特征精准锁定目标,而绝不错杀无辜?2023年底,普林斯顿大学的Tom W. Muir教授团队带来了一个令人振奋的答案。他们发明了一种名为SMART(全称是"Splicing-Modulated Actuation upon Recognition of Targets",可以理解为"基于识别靶点的剪接调控激活技术")的新型蛋白质装置。这项技术最大的特点就是:它会在细胞表面做数学题。
一、为什么要让细胞"做数学题"?
我们身体里的细胞就像一座座城市,细胞表面的各种蛋白质就是城市的"地标建筑"。正常细胞和癌细胞的地标组合是不同的。比如,某个正常细胞可能有地标A和B,而癌细胞可能有A、B和C,或者只有B和D。 以前的治疗方法通常只看一个地标——比如只看有没有B。但问题是,很多正常细胞也有B,这就导致误伤。
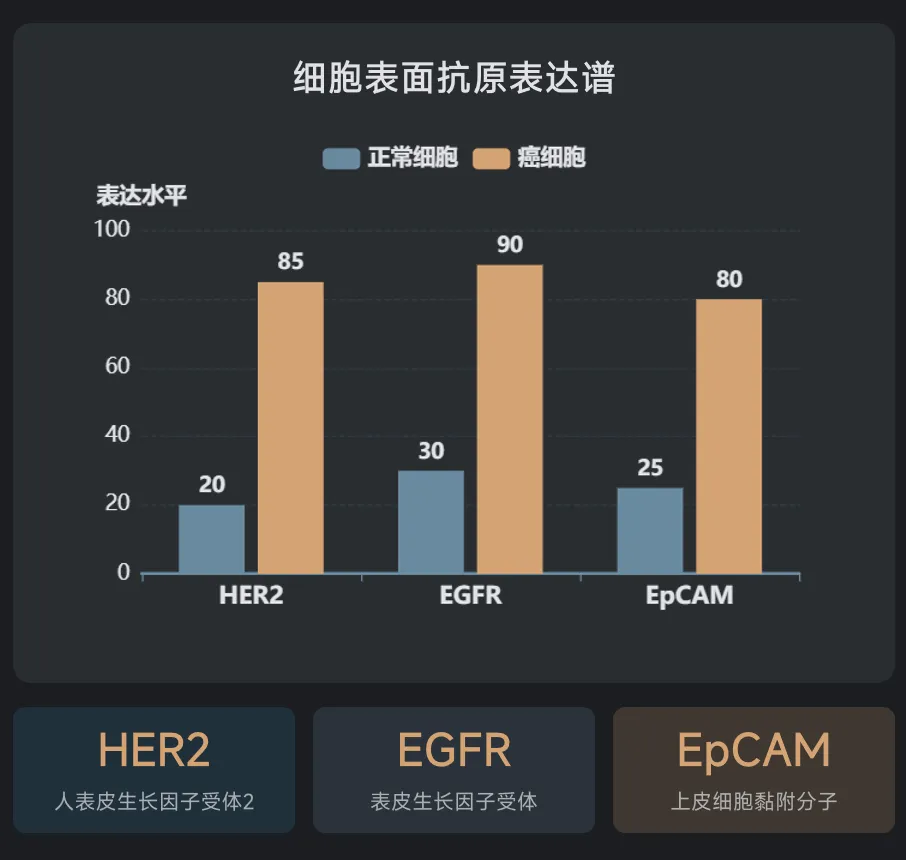
科学家们想,如果能同时检查两个甚至三个地标,只有当所有条件都满足时才动手,那 Accuracy(准确度)不就大大提高了? 这就是布尔逻辑运算的思路。简单来说,就是AND(并且)、OR(或者)、NOT(非)这样的逻辑判断。
比如:"如果有地标A并且有地标B,就启动攻击"——这就是AND逻辑。
"如果有A或者有B,就启动"——这是OR逻辑。"
"如果有A但是没有B,才启动"——这就是NOT逻辑。
二、SMART是什么?一把需要两把钥匙的分子锁
那么,怎么才能在微观世界里实现这种逻辑判断呢?Muir团队从自然界获得灵感,设计了一套精巧的"分子锁"系统。
这个系统的核心是一种叫做分裂内含肽(split intein)的蛋白质片段。你可以把它想象成一把被掰成两截的钥匙:上半截叫SpyN,下半截叫SpyC。SpyN和SpyC各自连接着一个"探测器"——通常是DARPin(一种人工设计的抗体模拟蛋白),用来识别细胞表面的特定地标(比如HER2、EGFR或EpCAM等抗原)。
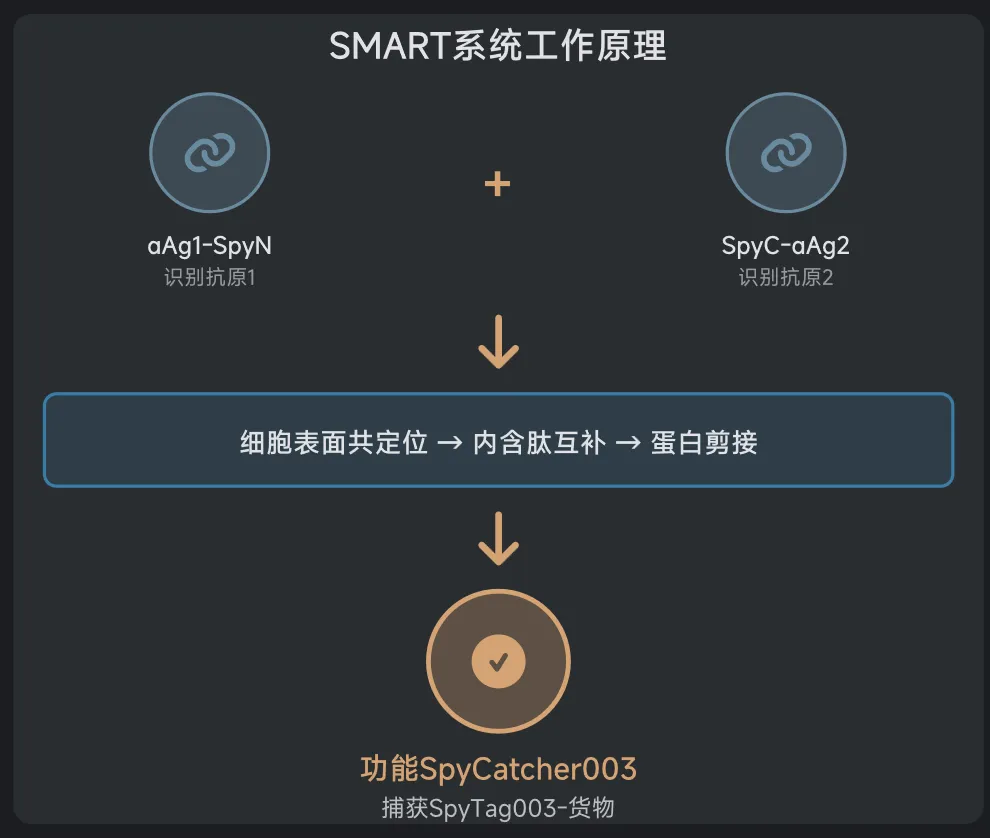
正常情况下,这两截钥匙在溶液里飘来飘去,各自独立,谁也打不开锁。只有当它们连接的探测器同时找到目标——也就是说,当SpyN粘在了HER2上,而SpyC粘在了EGFR上,而且这两个地标恰好出现在同一个细胞的表面时——这两截钥匙才会因为靠得太近而拼接在一起,重新组成一把完整的钥匙。
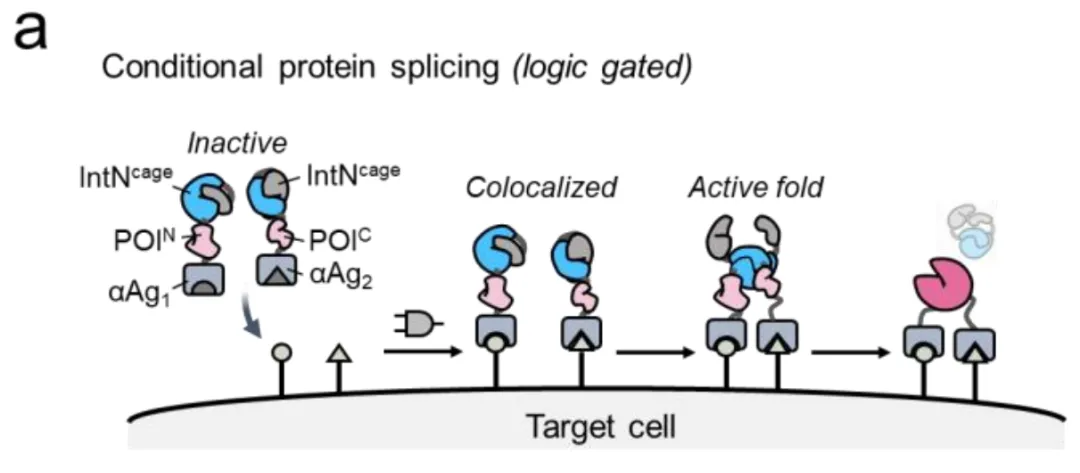
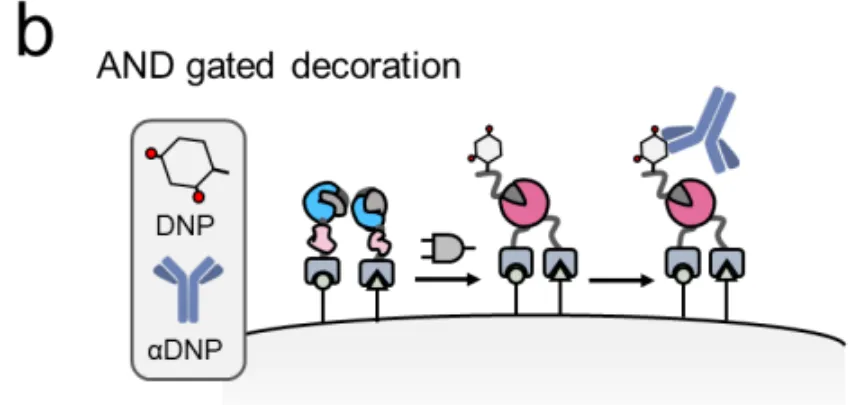
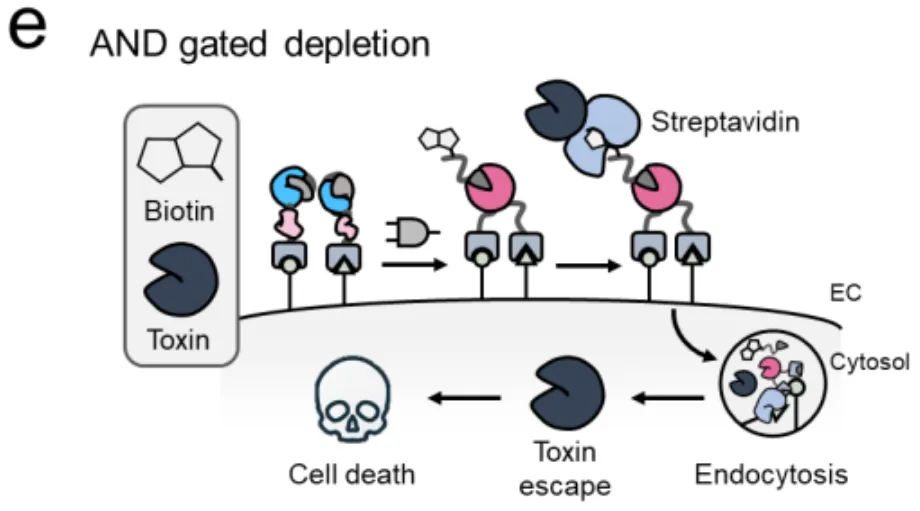
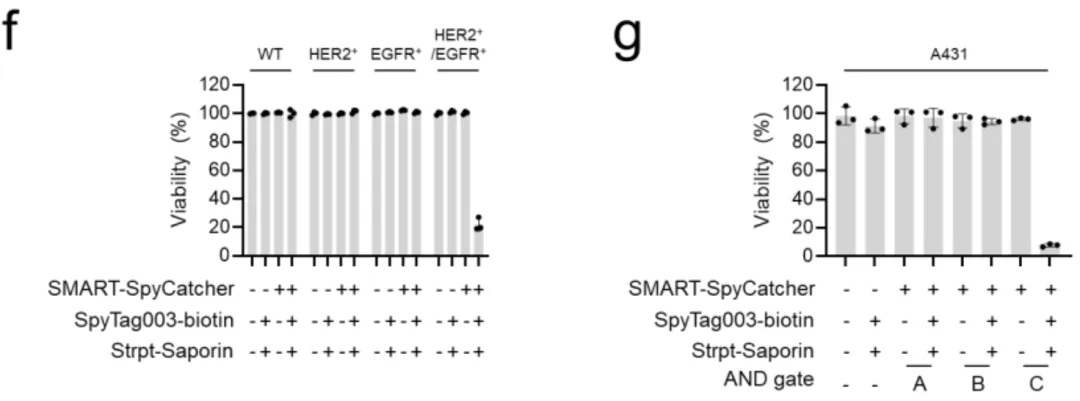
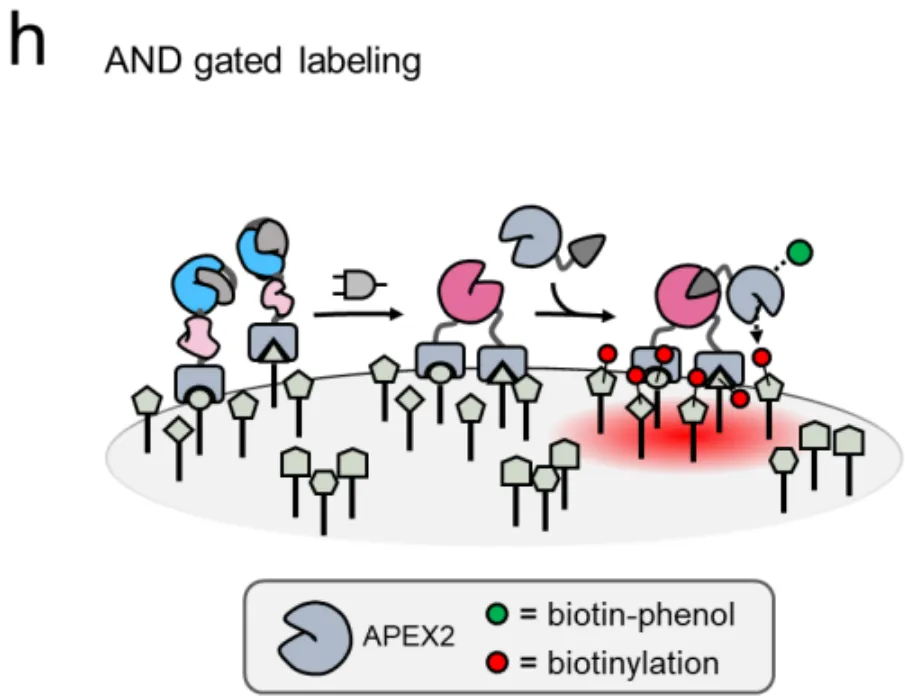
这把完整的钥匙一旦形成,就会立即启动"蛋白质剪接"(protein splicing)——一种分子级别的缝纫技术,把分裂的蛋白质无缝缝合成一个完整的SpyCatcher003蛋白。这个SpyCatcher003就像一个特定的"码头",可以牢牢抓住带有SpyTag标签的货物(比如荧光染料、毒素或抗体)。
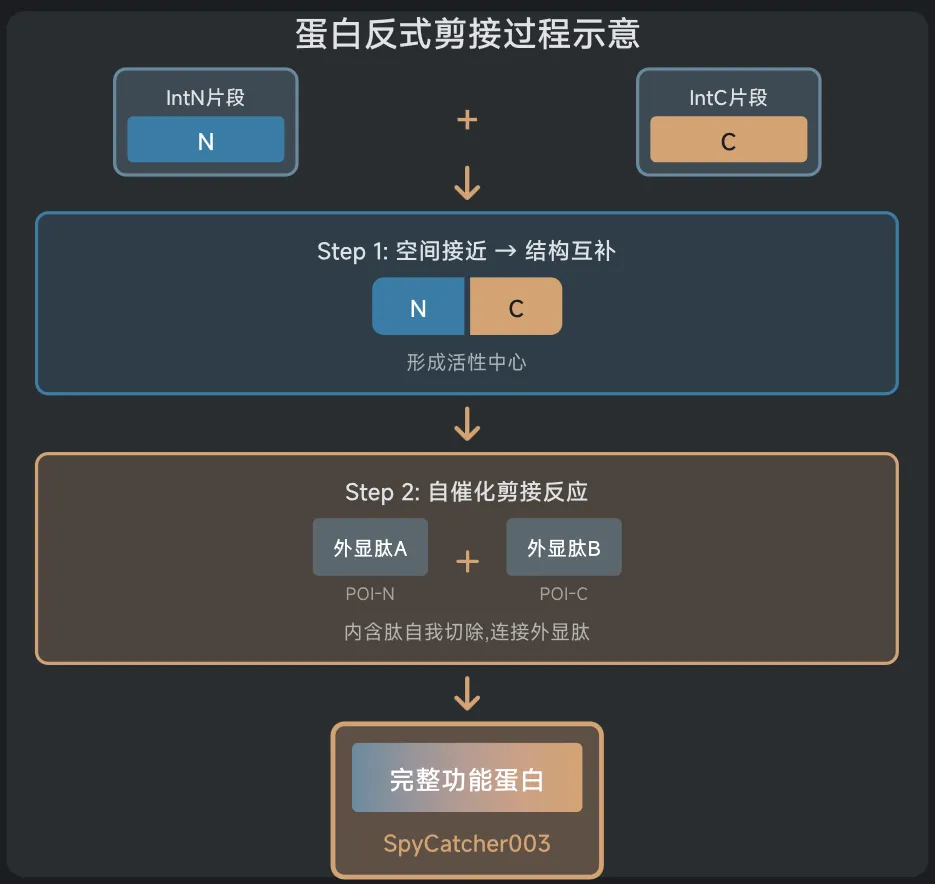
关键来了:只有当SpyN和SpyC都到位(AND逻辑),码头才会建成;如果只有一个到位,码头建不起来,货物就卸不了货。这就是SMART系统的基本工作原理。
三、实验结果:从培养皿到癌细胞的精准打击
接下来,让我们看看研究者们是如何一步步验证这套系统确实"聪明"且"可靠"的。
1. 基础测试:只有双阳性细胞才会亮灯
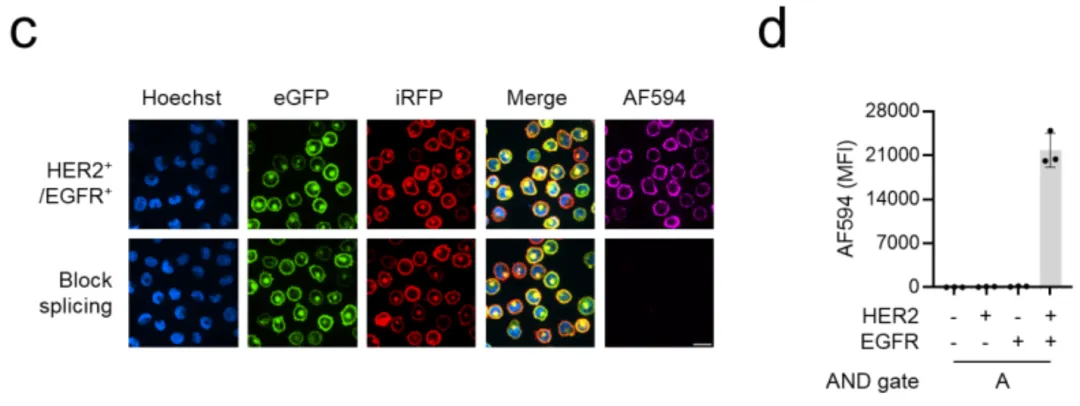
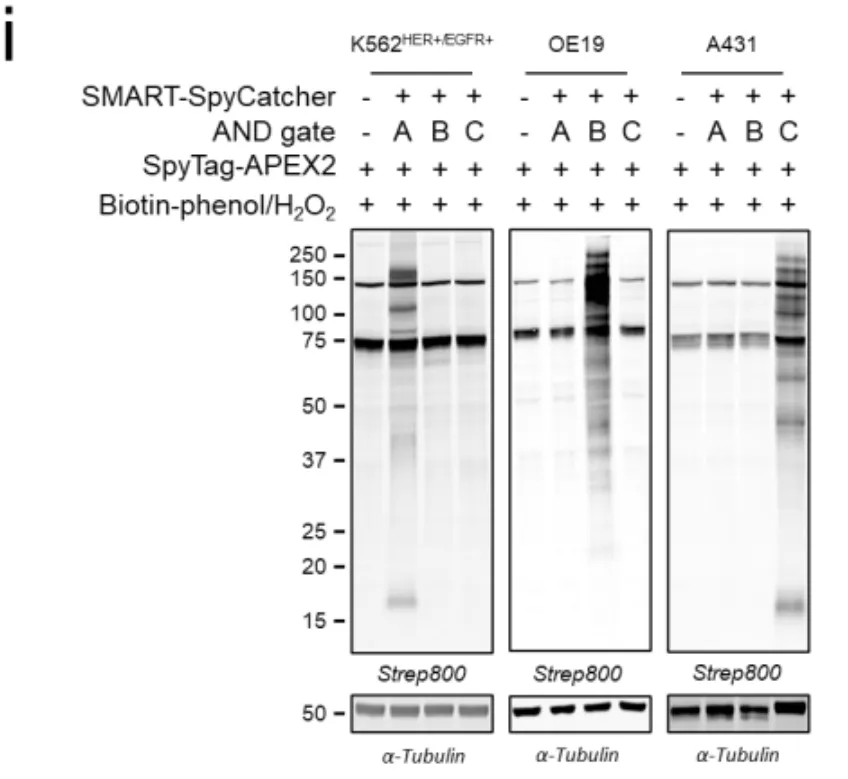
研究的第一步是在实验室培养的K562白血病细胞中测试最基本的AND逻辑。科学家们构建了四种细胞:野生型(什么都没有)、HER2单阳性(只有HER2)、EGFR单阳性(只有EGFR)、以及HER2/EGFR双阳性(两个都有)。
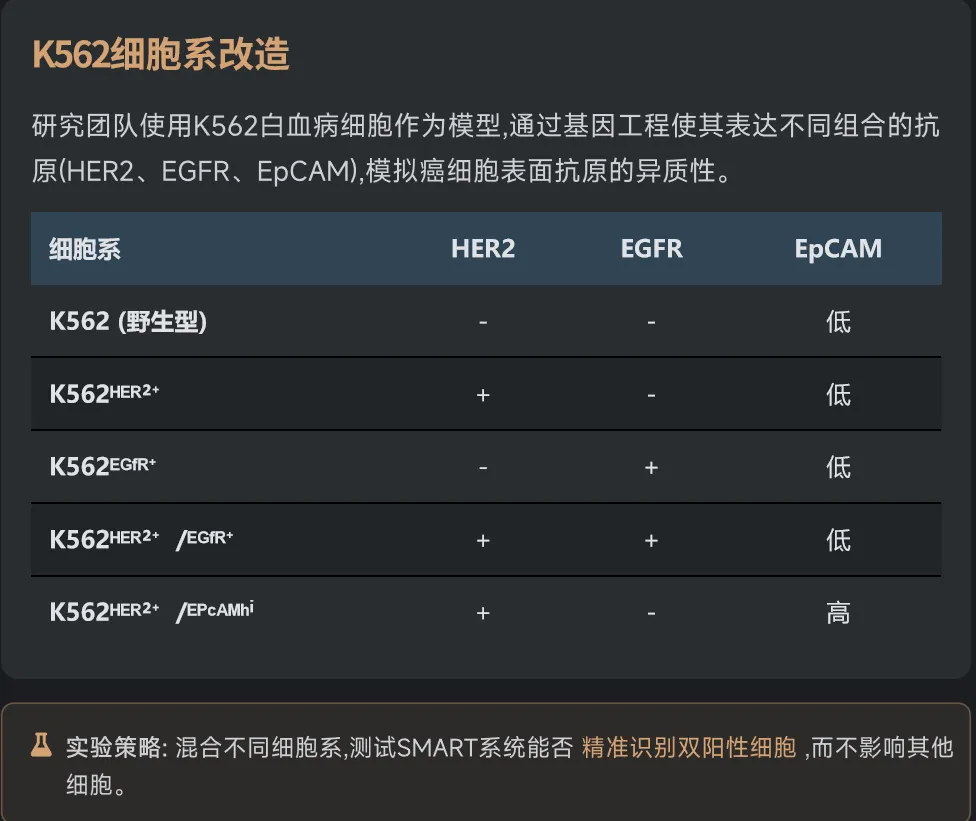
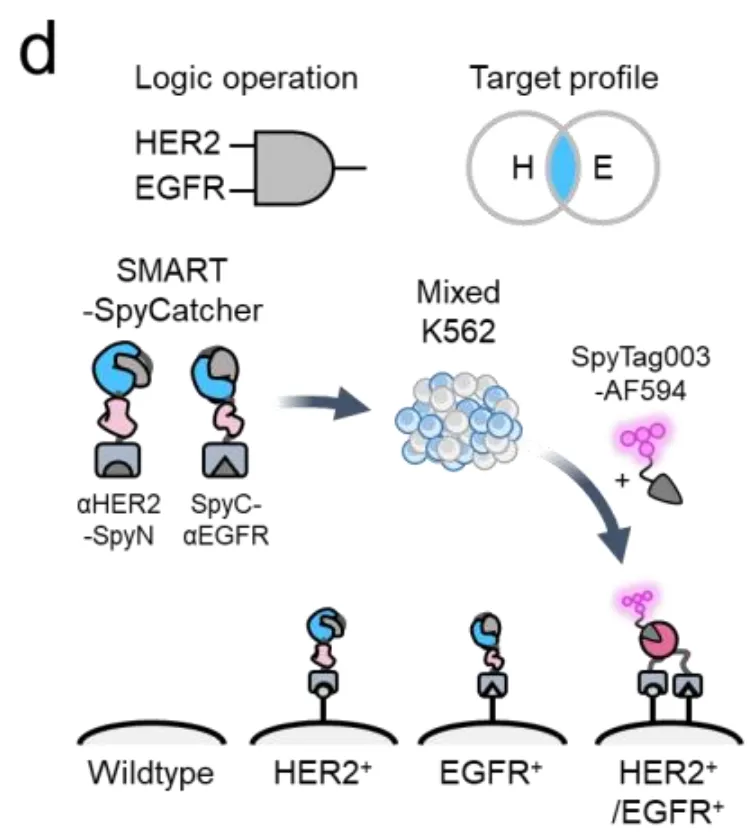
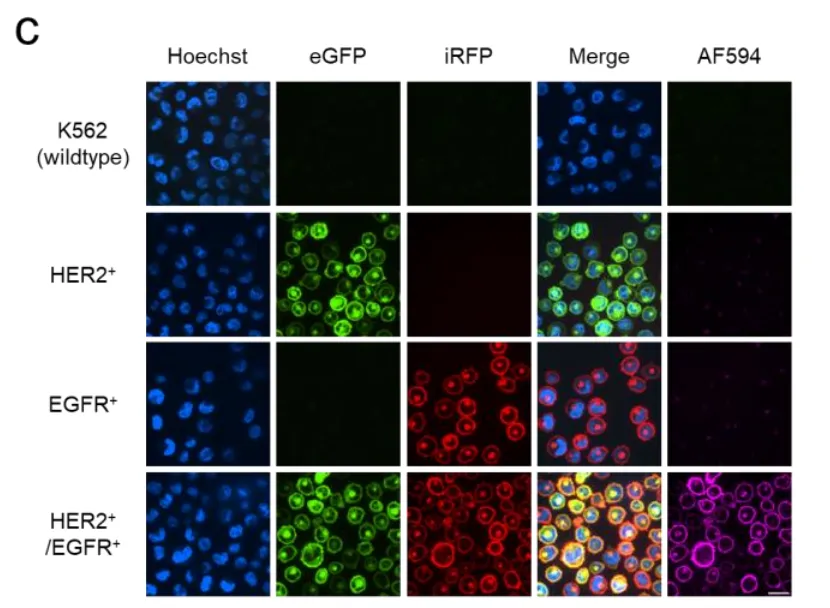
如图1c所示,当加入SpyN-HER2和SpyC-EGFR这对组合,再用带有红色荧光(AF594)的SpyTag探针检测时,只有双阳性细胞发出了强烈的紫色荧光。单阳性细胞和野生型细胞完全漆黑一片,就像从未接受过处理一样。
更让人印象深刻的是图1e的流式细胞术数据(可以理解为细胞通过激光检测的"体检报告")。在混合了四种细胞的群体中,只有双阳性细胞的荧光峰大幅右移,信号强度比背景高出20倍以上。
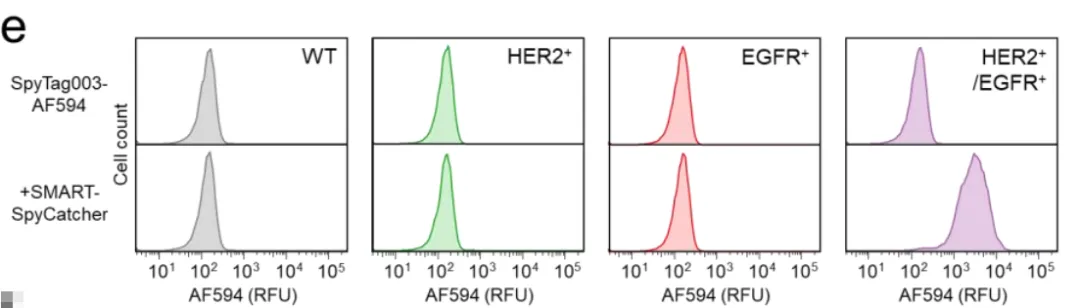
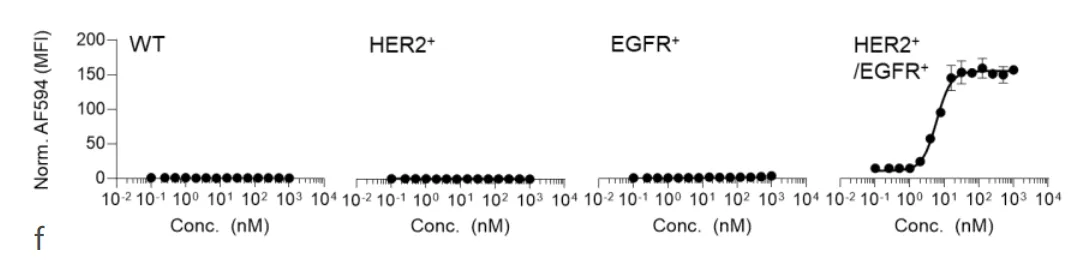
图1f的剂量实验显示,这个系统非常敏感,在低浓度(纳摩尔级别)就能工作,而且呈现出清晰的"全有或全无"的开关特性——浓度不够时完全没反应,达到一定阈值后突然全亮,然后饱和。这种"数字式"响应比传统的"模拟式"Gradual(渐进)响应要精确得多。
2. 逻辑升级:会做OR和NOT运算的智能系统
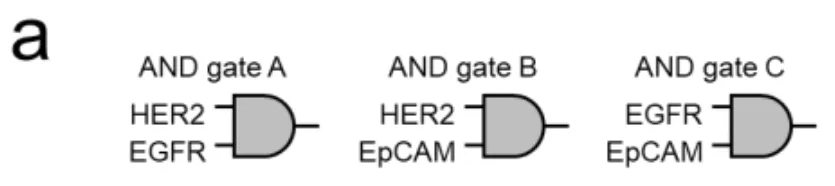
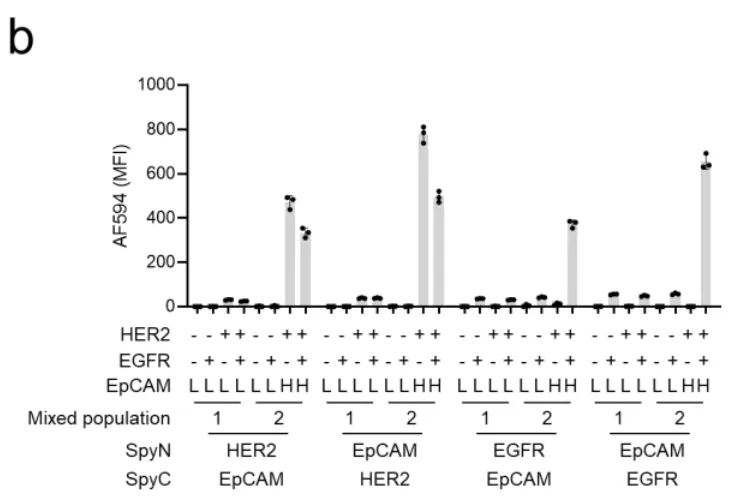
验证了AND门后,科学家们开始挑战更复杂的逻辑运算。如图2b所示,他们测试了EpCAM(另一种常见的肿瘤抗原)与HER2或EGFR的组合。结果显示,无论是[HER2 AND EpCAM]还是[EGFR AND EpCAM],系统都能精准识别双阳性细胞,而单阳性细胞保持沉默。
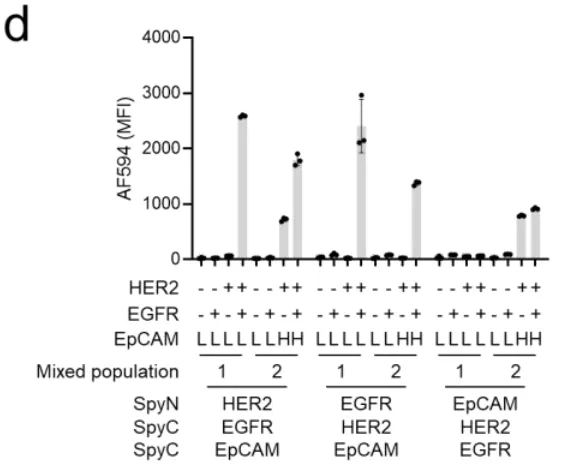
更有趣的是图2d展示的OR逻辑。科学家们设计了一个"双保险"系统:SpyN靶向HER2,但同时准备了两把SpyC——一把靶向EGFR,另一把靶向EpCAM。在混合细胞群中,只要细胞表达HER2,并且表达EGFR或者EpCAM中的任意一个,系统就会被激活。实验数据显示,HER2+/EGFR+细胞和HER2+/EpCAM+细胞都发出了强烈的荧光信号,实现了"二选一"的智能识别。
最巧妙的要数图2e-f展示的NOT逻辑,也就是"排除法"。科学家们设计了一个"诱饵"(Decoy)——一个看似正常的SpyN,但它识别的是EGFR,而且即使与SpyC拼接后,也形成功能缺陷的码头,无法结合SpyTag。
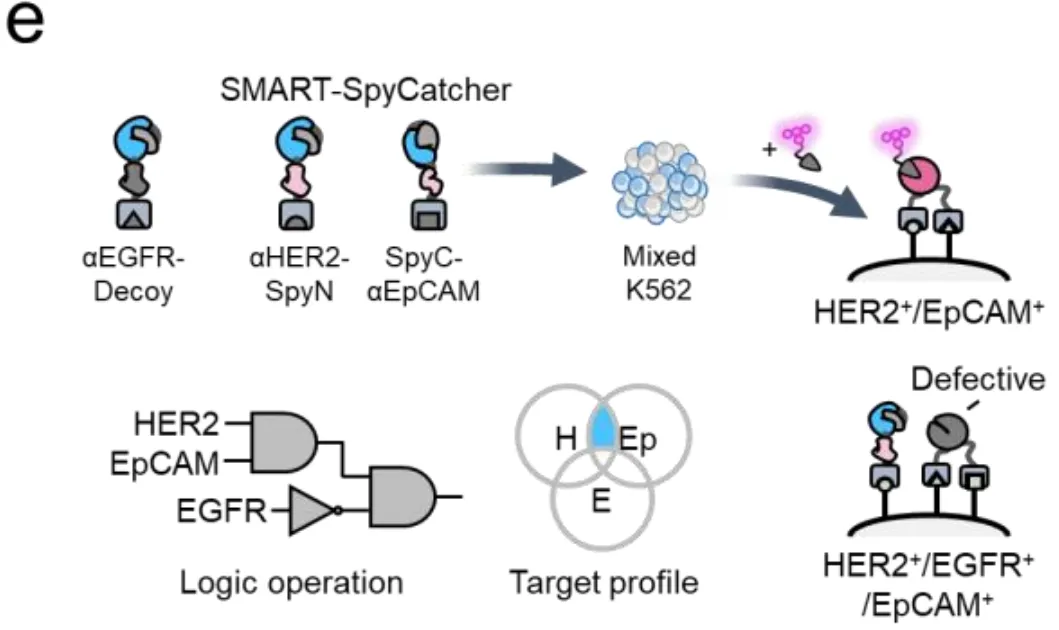
在实验中(图2f),当混合群体(包括HER2+/EpCAM+双阳性细胞和HER2+/EGFR+/EpCAM+三阳性细胞)同时接触真SpyN(抗HER2)、SpyC(抗EpCAM)和诱饵(抗EGFR)时,神奇的事情发生了:双阳性细胞(没有EGFR,所以诱饵粘不上去)正常发光;而三阳性细胞因为诱饵抢先与SpyC结合,占据了资源,导致真SpyN无法形成有效码头,信号被抑制了72%。
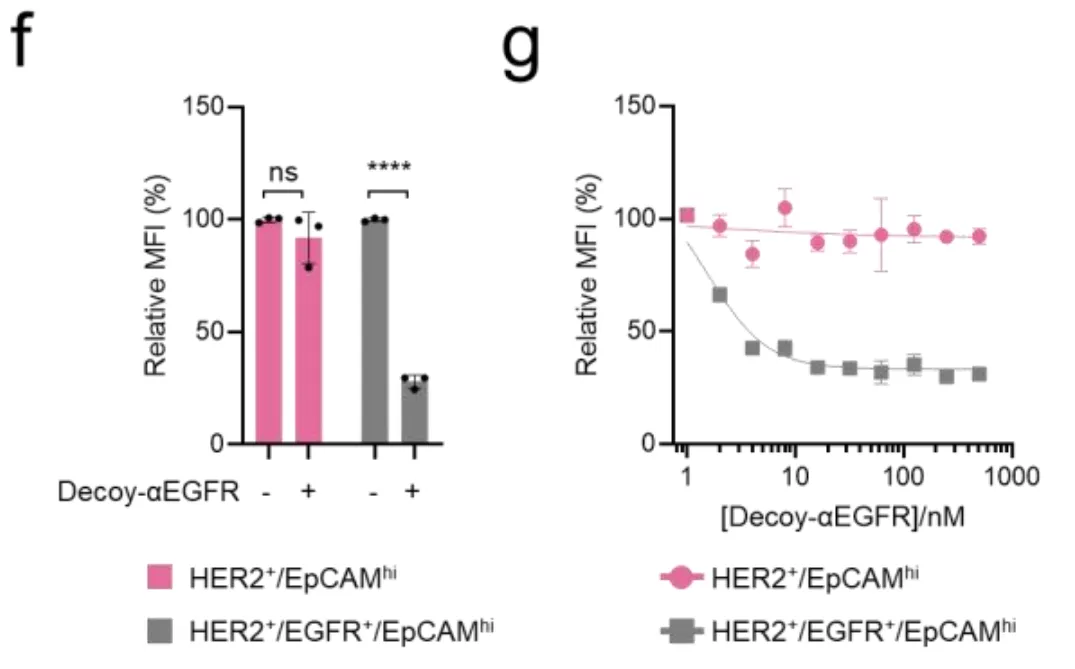
图2g显示,随着诱饵浓度的增加,三阳性细胞的信号逐渐降低,而双阳性细胞完全不受影响。这就实现了"如果有EGFR,就不干活"的NOT逻辑。
3. 实战演练:识别真实癌细胞
实验室里的工程细胞表现良好,但真正的考验是来自患者的癌细胞。如图3a所示,研究人员检测了多种真实癌细胞系(包括肺癌、乳腺癌、胃癌细胞)表面HER2、EGFR和EpCAM的自然表达水平。这些表达水平是细胞天生的,没有经过任何人工改造。
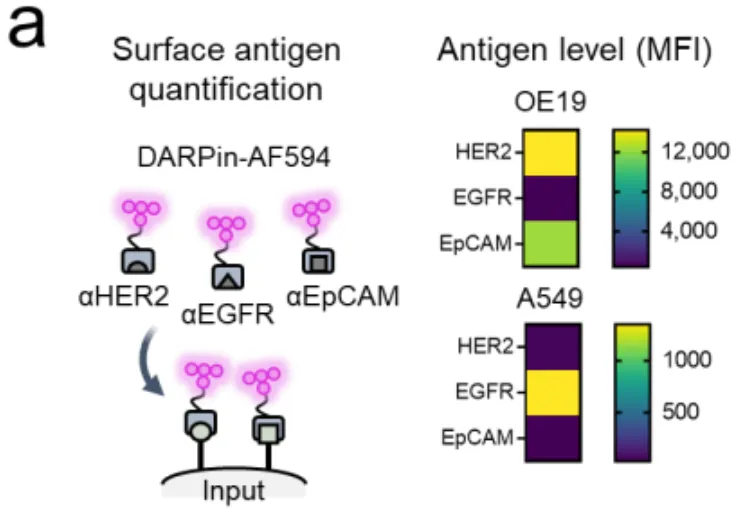
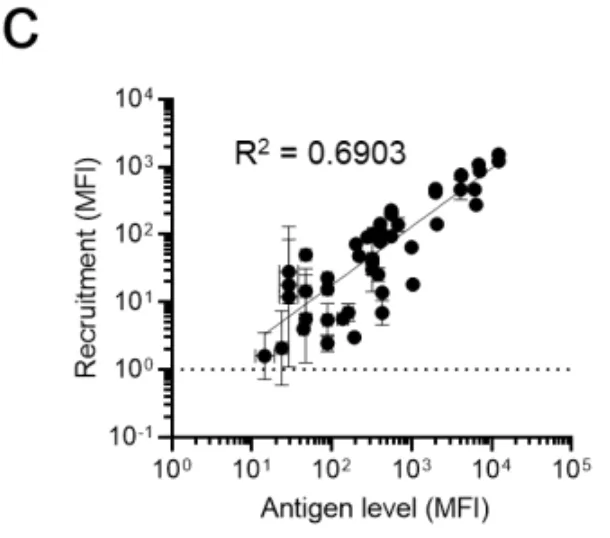
图3c显示了一个重要发现:SMART系统的激活强度与逻辑门中表达量较低的那个抗原水平呈正相关。换句话说,系统遵循"木桶原理"——靶向效果取决于最短缺的那种抗原。这意味着如果某个细胞高表达HER2但低表达EGFR,AND门会保护这种细胞不被误伤,因为EGFR水平太低,两个组件碰面的机会太少。
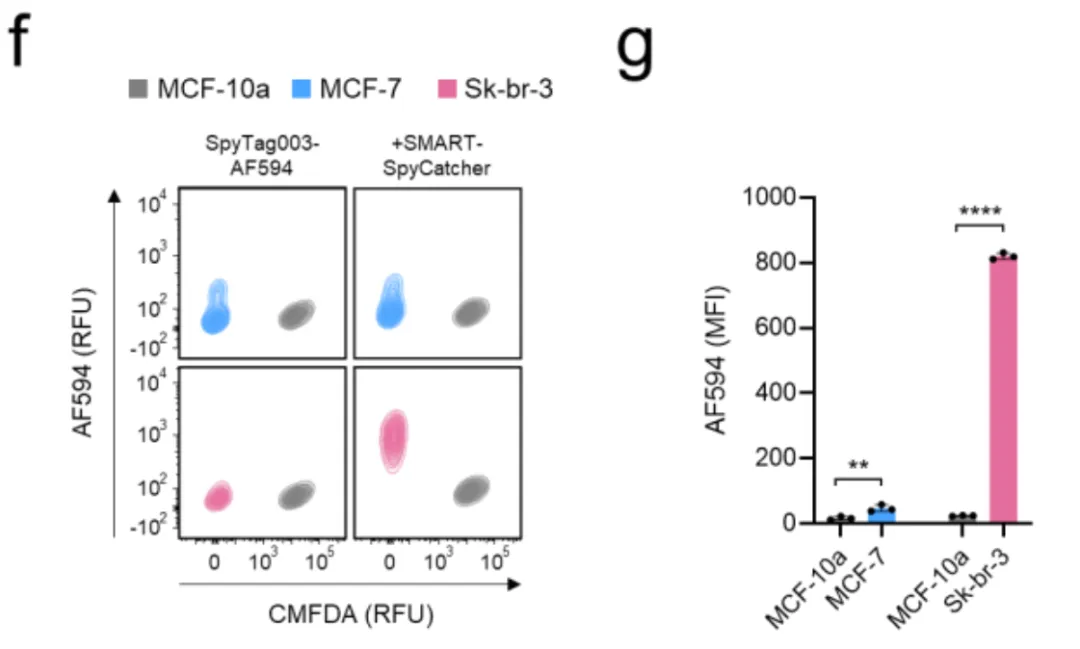
在图3d-g中,研究者们模拟了真实的肿瘤微环境,将正常乳腺上皮细胞MCF-10a(HER2低、EpCAM低)分别与乳腺癌细胞MCF-7(HER2低、EpCAM高)和Sk-br-3(HER2高、EpCAM高)混合。
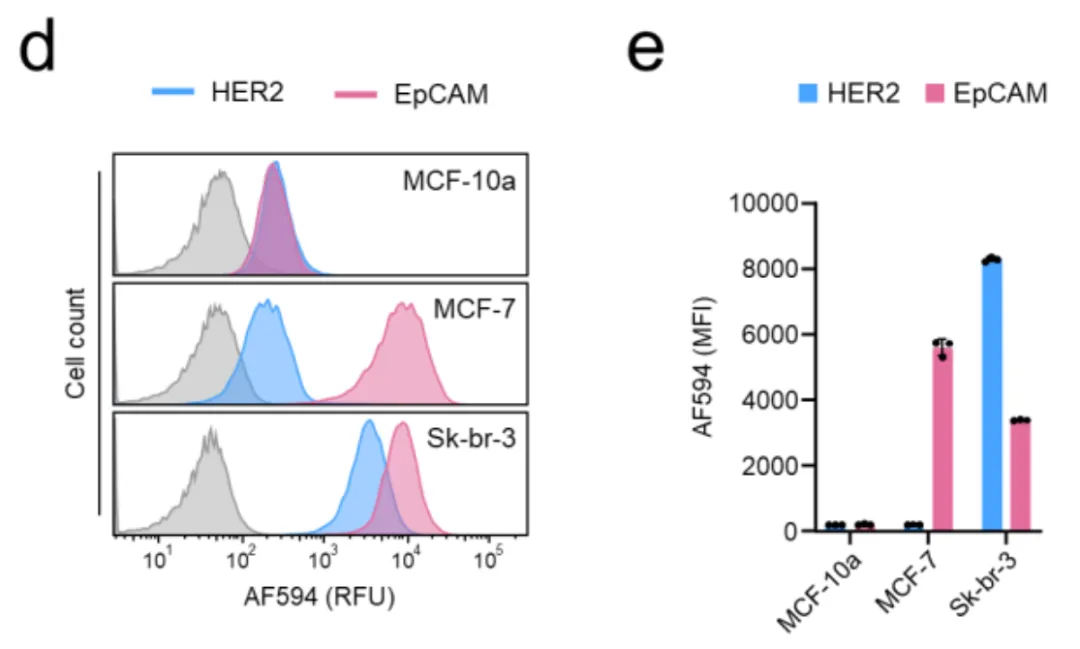
使用[HER2 AND EpCAM]逻辑门时,只有Sk-br-3细胞被标记,正常细胞和另一种癌细胞几乎完全"隐身"。这证明了系统能够区分表达谱相似但有细微差异的细胞群体。