


Rewiring of 3D chromatin topology orchestrates transcriptional reprogramming in muscle fiber-type specification and transformation..pdf

一、研究概况
研究旨在揭示三维基因组结构如何与表观遗传状态协同调控骨骼肌纤维类型(慢肌/氧化型 vs. 快肌/糖酵解型)的决定与转化。这一科学问题对于理解人类代谢疾病(如II型糖尿病)和改良畜禽肉品质具有双重重要意义。1. 研究背景与动机:
生理与产业重要性:骨骼肌纤维的组成直接决定其收缩特性和代谢模式。在人类中,慢肌纤维比例高有助于葡萄糖稳态,而向快肌纤维的转化与胰岛素抵抗和II型糖尿病相关。在畜牧生产中,富含慢肌纤维的肌肉(如比目鱼肌,SOL)通常具有更佳的肉色(红度更高)、更高的肌内脂肪含量和持水性,因而肉品质优于富含快肌纤维的肌肉(如趾长伸肌,EDL)。
科学前沿:近年来,三维基因组学(3D Genomics)的发展揭示了染色质的空间构象(如染色质环、拓扑关联域TADs、A/B区室)对基因精确调控的关键作用。然而,3D基因组结构如何动态重组以驱动肌纤维类型特异性转录程序,仍不甚清晰。
研究的技术路线概述清晰展示了从样本采集到多组学分析及功能验证的整体设计: 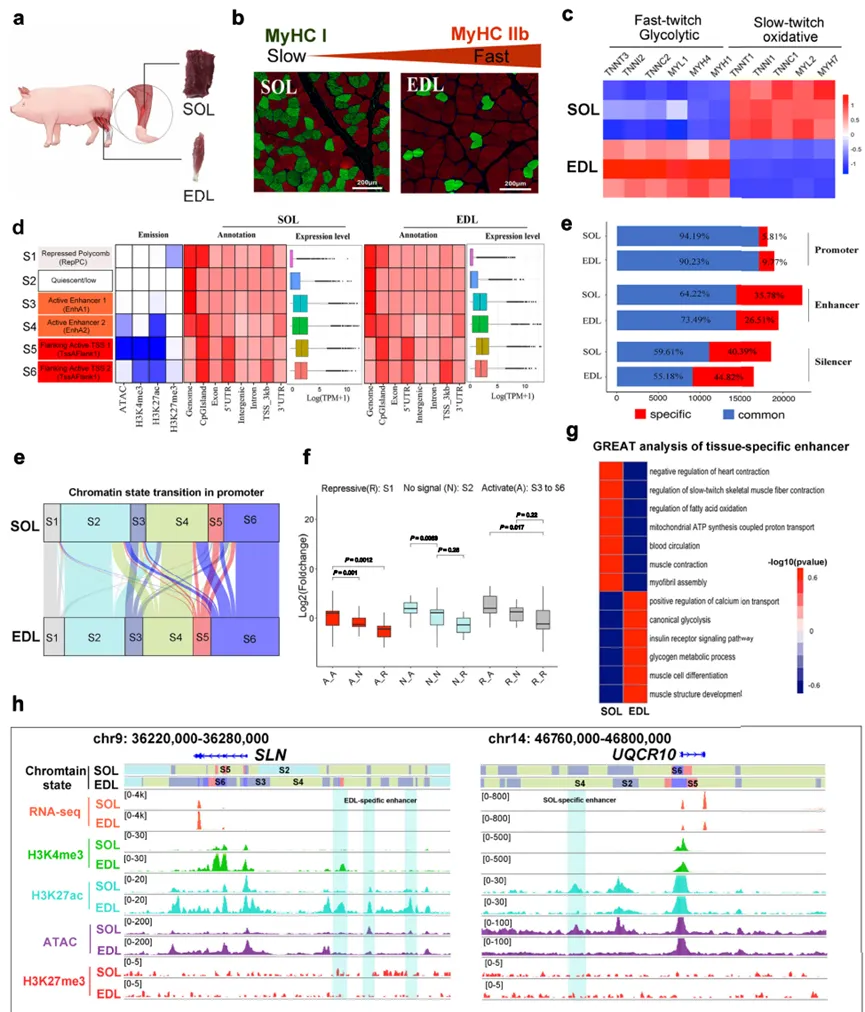
二、 重点问题解析与核心发现
本研究系统性地回答了从宏观基因组架构到微观基因调控等多个层面的关键问题。1. SOL与EDL肌肉的转录组和表观遗传景观存在显著差异
研究首先证实了猪SOL和EDL的纤维类型差异:SOL高表达慢肌肌球蛋白基因MYH7,而EDL高表达快肌基因MYH1和MYH4。通过ChromHMM对表观遗传标记进行分析,定义了6种染色质状态,并鉴定出大量组织特异性的启动子和增强子。这些特异性顺式调控元件(CREs)邻近的基因富集于肌肉收缩和代谢等关键通路,例如EDL特异性增强子靠近调控快肌收缩的SLN基因,而SOL特异性增强子靠近参与氧化磷酸化的UQCRIO基因。这初步表明,表观遗传状态的差异是肌纤维功能分化的基础。2. 三维基因组宏观结构保守,但微观相互作用动态变化
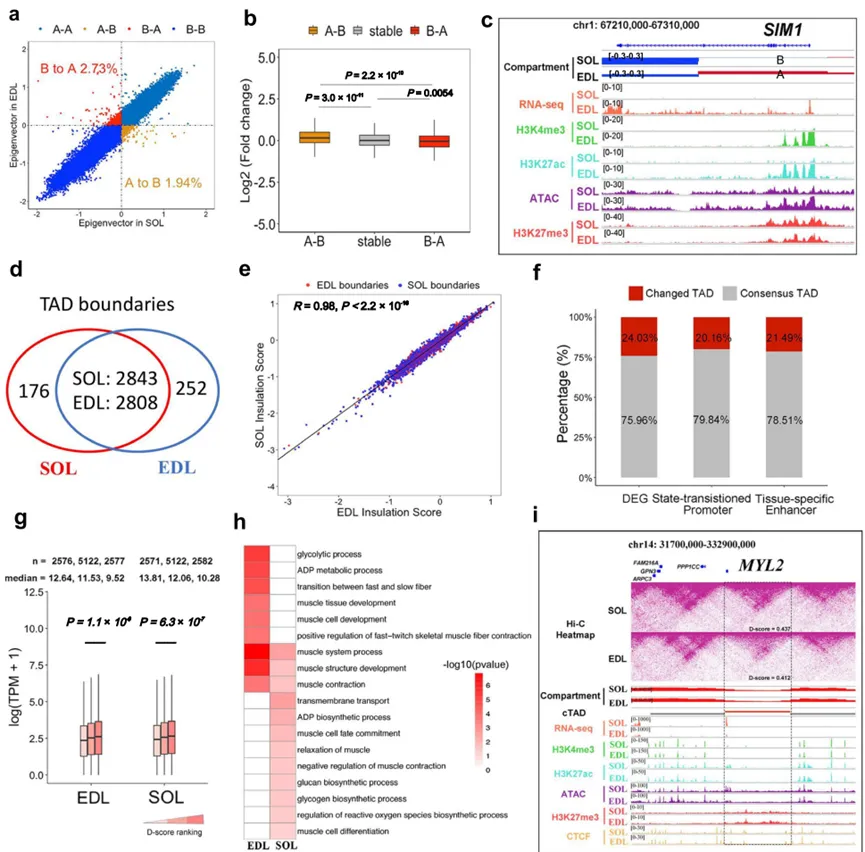
3. 增强子-启动子(E-P)互作的全局重塑是功能分化的核心驱动力
这是本研究的亮点之一。通过染色质环(loop)调用,发现E-P互作是数量最多的环类型,且与基因激活关系最密切。- E-P重编程与基因表达:研究人员根据E-P互作模式将基因分为三组:SOL特异性互作(Group III)、EDL特异性互作(Group II)和共同互作(Group I)。结果表明,具有组织特异性E-P互作的基因,其表达也呈现相应的特异性。例如,慢肌肌钙蛋白TNNI1与SOL特异性增强子互作,而快肌肌钙蛋白TNNI2与EDL特异性增强子互作。
- 关键转录因子:motif分析发现,SOL特异性增强子富集AP-1转录因子家族(如FOS),而EDL特异性增强子则富集KLF家族(如KLF5)。这提示不同的转录因子群协同组织特异的3D基因组互作,从而塑造不同的肌纤维表型。
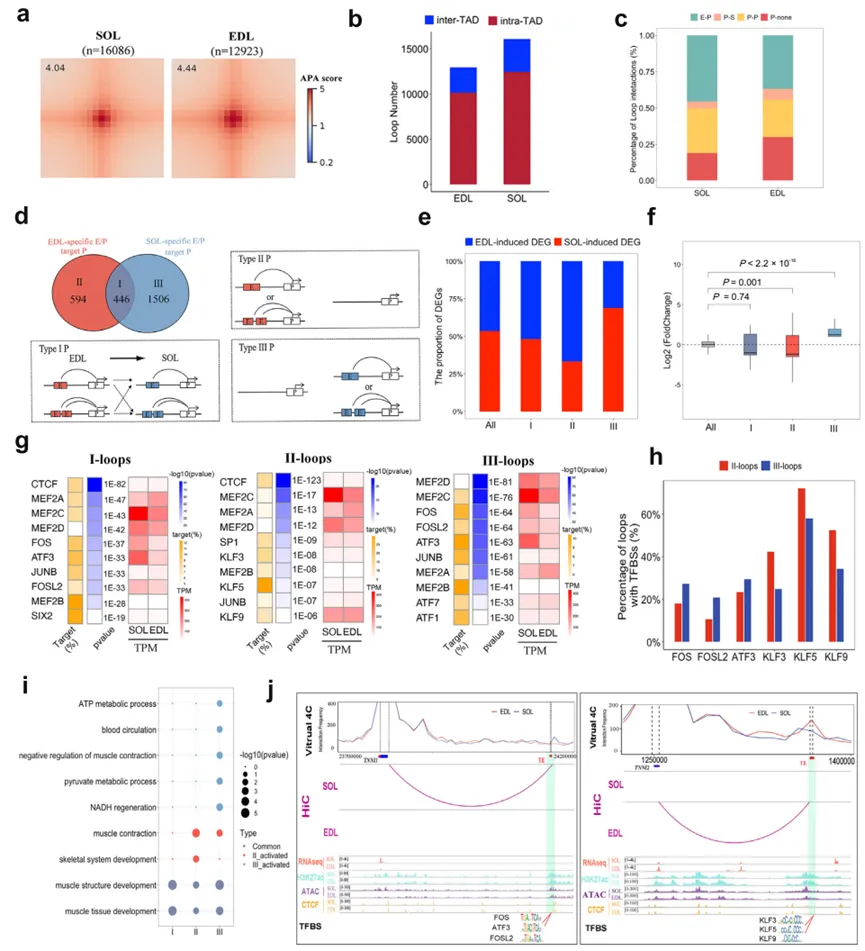
4. 超级增强子(SE)通过染色质环化调控肌纤维类型决定
超级增强子作为调控细胞身份的关键元件,在本研究中被重点阐释。
- SE与肌球蛋白基因调控:研究发现了一个EDL特异性的SE(SE-MYH1/4),它通过染色质环与快肌肌球蛋白基因MYH1和MYH4的启动子相互作用,驱动其表达。相反,在SOL中,MYH7启动子区域存在一个活跃的SE(SE-MYH7)。通过CRISPR-Cas9原位删除这些SE,能显著降低相应肌球蛋白基因的表达,直接证明了其必要性。
- KLF5是EDL中SE功能的关键执行者:KLF5在EDL中高表达,且被证实能结合在SE-MYH1/4上。过表达KLF5可增强SE-MYH1/4的增强子活性,促进其与靶基因的环化作用,并上调MYH1/MYH4的表达。这揭示了KLF5是促进快肌纤维分化的一个上游主调控因子。
SE如何通过空间临近与环化调控关键肌球蛋白基因,其三维模型非常直观:
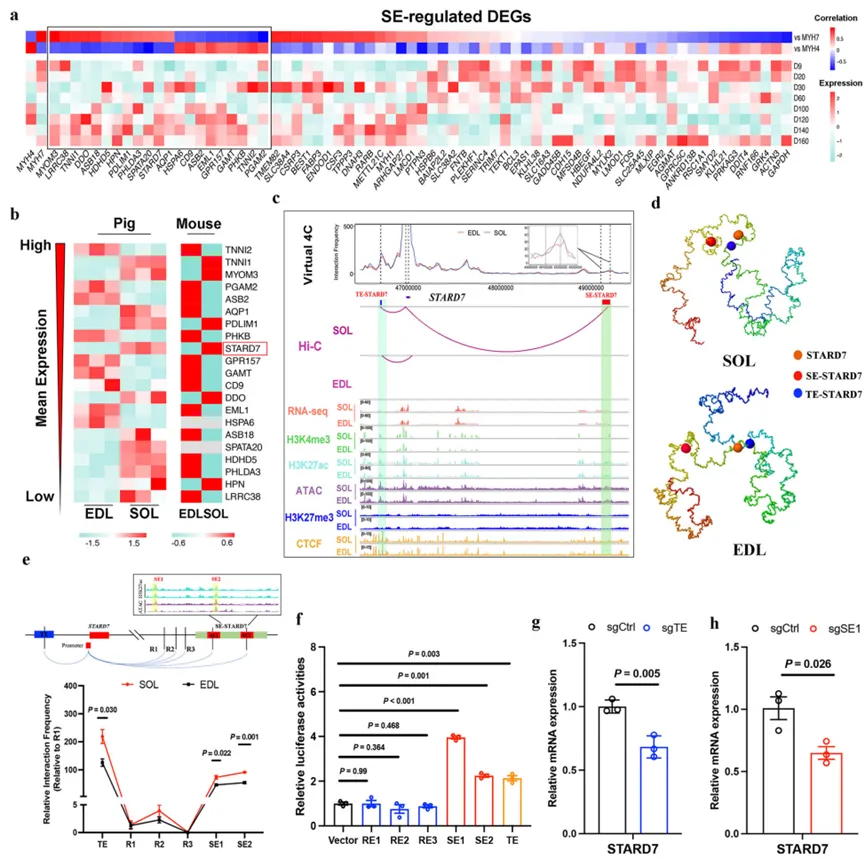
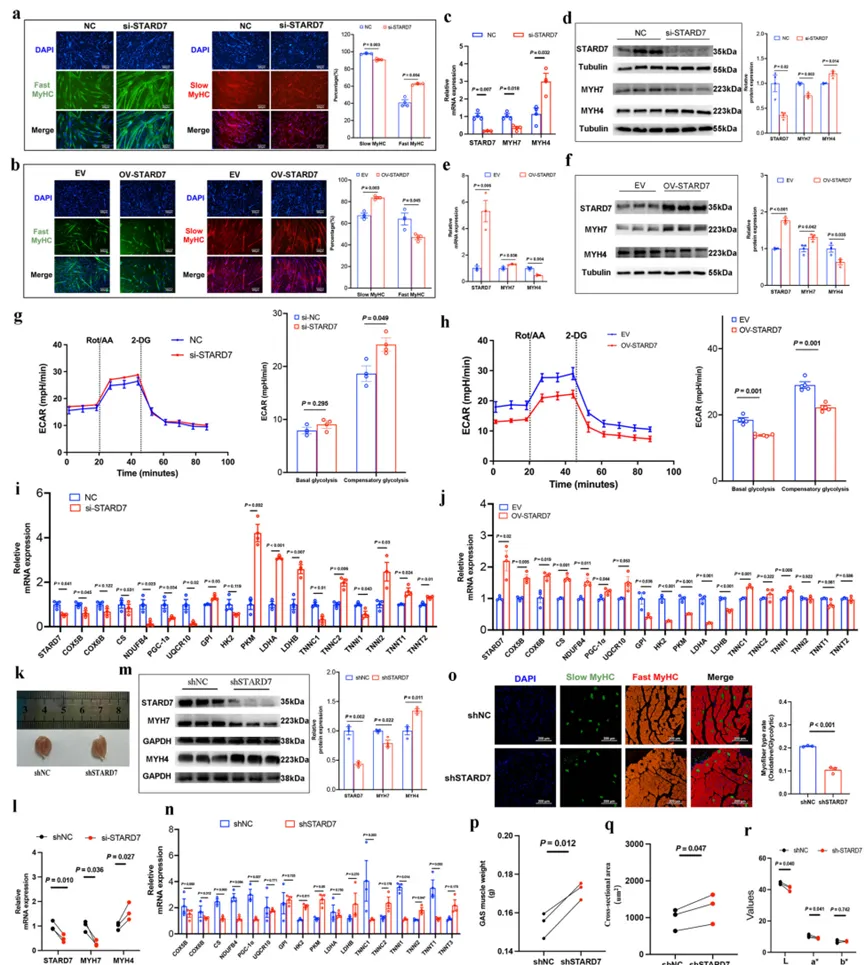
5. SE驱动的STARD7表达促进糖酵解纤维向氧化纤维转化
这是本研究最具突破性的发现,将3D基因组调控与肌纤维转化的生理功能直接联系起来。- STARD7的发现与验证:通过分析SE锚定基因在肌肉发育中的表达相关性,研究人员筛选出STARD7作为一个关键的候选基因。STARD7表达与MYH7正相关,与MYH4负相关。一个远端SE(SE-STARD7)通过环化作用激活STARD7的表达。
- 功能获得与缺失实验:在体外猪卫星细胞和体内小鼠腓肠肌模型中,过表达STARD7能诱导肌管向氧化/慢肌类型转化,表现为氧化代谢基因和慢肌肌钙蛋白基因上调,糖酵解能力下降;而敲低STARD7则得到相反的效果。尤为重要的是,体内实验发现敲低Stard7会导致肌肉重量增加、肉色变浅(L值升高)和变红(a值升高),这直接模拟了畜禽中快肌纤维比例高导致的肉品质下降表型。
- 作用机制:RNA-seq和生化分析揭示,STARD7通过降低细胞内活性氧(ROS)水平,进而抑制ERK MAPK信号通路活性,最终驱动纤维类型向氧化型转化。这一STARD7-ROS-ERK轴为理解肌纤维可塑性提供了新的分子通路。
STARD7在调控肌纤维转化中的核心作用及其分子机制总结如下:
三、 启示与展望
1. 提供了肉质性状改良的新靶点和新思路:传统育种主要关注MYH7等肌球蛋白基因本身的表达量。本研究将视角提升至调控这些基因的“调控开关”——超级增强子和三维基因组结构。KLF5作为促进快肌纤维发育的因子,可能成为负向选择的潜在靶点,以降低肌肉中快肌纤维比例。而STARD7作为一个促进氧化/慢肌纤维转化的正向因子,则可能通过基因编辑或分子标记辅助选择等手段进行利用,以期培育出肉品质更优(肌内脂肪丰富、肉色佳、持水性强)的畜禽新品种。
2. 强调了“三维基因组育种”的潜力:本研究雄辩地证明,基因组的空间结构是影响重要经济性状的关键层。未来在畜禽育种中,除了关注基因序列的变异(SNPs),或许还应考虑那些影响染色质环化和SE形成的基因组变异,这些变异可能通过改变关键基因的调控效率来影响表型。这为理解复杂性状的遗传机制开辟了新维度。
3. 猪作为人类代谢疾病模型的验证:本研究在猪模型上发现的STARD7功能在小鼠实验中得到了保守性验证,这不仅增强了研究发现的可信度,也进一步巩固了猪作为研究人类肌肉代谢疾病(如肌肉减少症、胰岛素抵抗)的优质大型动物模型的地位。
4. 技术方法的借鉴:本研究整合的多组学分析方法、BL-Hi-C技术、以及将bulk组织与纯化肌核表观遗传信号对比的策略,为在畜禽研究中开展类似工作提供了宝贵的技术路线参考。
四、 总结
该研究首次在大型哺乳动物(猪)中系统描绘了肌肉纤维类型特异的三维基因组蓝图,并深刻揭示了三维基因组拓扑结构重编程通过调控超级增强子及其靶基因,是决定和转化肌肉纤维类型的核心机制。特别是发现了STARD7是介导糖酵解纤维向氧化纤维转化的关键效应因子,并阐明了其通过ROS-ERK信号通路发挥作用。这些发现不仅极大地增进了我们对肌肉生物学的基本认知,也为畜禽肉质性状的遗传改良和人类代谢健康的干预策略提供了全新的理论依据和极具价值的候选靶点。未来的育种实践需要更多地关注基因调控网络的空间维度,从而更精准、更高效地实现育种目标。