脂质代谢重编程驱动双病进展:解码动脉粥样硬化与癌症中脂质负载巨噬细胞的共性与特异性机制
- 2026-02-05 00:39:55

前言
本综述围绕脂质负载巨噬细胞(LL-Macs)在动脉粥样硬化(泡沫细胞 FC-Macs)和癌症(脂质负载肿瘤相关巨噬细胞 LL-TAMs)中的核心作用,先系统阐述巨噬细胞脂质代谢(摄取、合成、氧化、储存)对 M1/M2 极化的调控机制,再分别解析两种疾病中 LL-Macs 的形成诱因(动脉粥样硬化以 oxLDL 摄取为主,癌症以肿瘤微环境脂质供给为主)、功能差异(FC-Macs 促斑块炎症与不稳定,LL-TAMs 促免疫抑制与肿瘤进展),通过单细胞 RNA 测序挖掘两者共享(CD36、FABP5、PLIN2)与独特基因特征,最后评估动脉粥样硬化相关脂质调节药物(他汀类、PCSK9 抑制剂等)在癌症中的潜在应用价值。结论为 LL-Macs 通过脂质代谢重编程成为连接两种疾病的关键病理细胞,存在保守分子靶点,动脉粥样硬化相关脂质调节策略有望跨疾病 repurposing,但需结合疾病特异性微环境(系统血脂紊乱 vs 肿瘤局部脂质富集)优化治疗方案,为双病共防共治提供新理论基础。
研究要点解析
研究方法
首先综述巨噬细胞脂质代谢(摄取、合成、脂肪酸氧化、胆固醇外流等)对 M1/M2 极化的调控规律,明确脂质代谢与巨噬细胞功能的关联;随后分别聚焦动脉粥样硬化中 FC-Macs 的形成机制(oxLDL 摄取、溶酶体功能障碍、胆固醇代谢紊乱)及病理功能,与癌症中 LL-TAMs 的脂质来源(肿瘤细胞分泌、微环境脂质富集)、极化信号(PI3K/mTOR、PPARγ)及免疫抑制作用;通过整合单细胞 RNA 测序数据,挖掘两种疾病中 LL-Macs 的共同与独特基因签名;最后系统评估动脉粥样硬化相关脂质调节药物(他汀类、PCSK9 抑制剂、胆固醇酯转移酶抑制剂等)的作用机制,分析其在癌症治疗中的潜在应用场景与研究缺口。
研究结果
巨噬细胞脂质代谢直接调控极化:炎症状态(M1 样)依赖脂质合成与储存,修复状态(M2 样)依赖脂肪酸氧化(FAO),脂质过载通过内质网应激激活炎症通路;动脉粥样硬化中 FC-Macs 由 oxLDL 经 CD36、LOX-1 等受体摄取形成,胆固醇晶体激活 NLRP3 inflammasome 促炎,胆固醇外流障碍加剧斑块进展;癌症中 LL-TAMs 通过 CD36、MARCO 摄取肿瘤来源脂质,激活 PPARγ/FABP5 通路促 M2 样极化,上调 PD-L1、分泌 PGE2 抑制 CD8+T 细胞功能;单细胞 RNA 测序显示两者共享 CD36、FABP5、PLIN2 等脂质代谢基因,LL-TAMs 额外富集 LGALS1/3 等免疫抑制基因,FC-Macs 高表达炎症相关基因(MMP9);动脉粥样硬化药物中,他汀类可重编程 TAM 极化、PCSK9 抑制剂增强肿瘤免疫应答,胆固醇合成抑制剂在癌症模型中显示抗瘤活性,但直接靶向 LL-TAMs 脂质代谢的临床证据仍匮乏。
研究结论
本综述首次系统整合脂质负载巨噬细胞在动脉粥样硬化与癌症中的跨疾病机制,核心贡献在于揭示了 LL-Macs 通过脂质代谢重编程驱动两种疾病进展的共性规律,挖掘出 CD36、FABP5 等可跨病靶向的分子靶点,为动脉粥样硬化相关脂质调节药物的癌症 repurposing 提供了理论支撑。但研究存在局限性:缺乏两种疾病中 LL-Macs 的直接临床样本对比数据,难以明确脂质代谢特征的疾病特异性关联强度;LL-TAMs 脂质代谢的细胞自主性与肿瘤微环境调控的因果关系尚未通过功能实验完全验证;现有药物研究多聚焦癌症细胞或整体免疫,直接靶向 LL-Macs 脂质代谢的临床前数据不足,且跨疾病药物应用的安全性与剂量优化缺乏研究;未明确 LL-Macs 脂质代谢与其他病理细胞(如血管平滑肌细胞、肿瘤相关成纤维细胞)的互作机制。后续需开展针对性临床前研究验证共同靶点的干预效果,积累临床样本数据,推动跨疾病治疗策略的转化。
图文结果解读
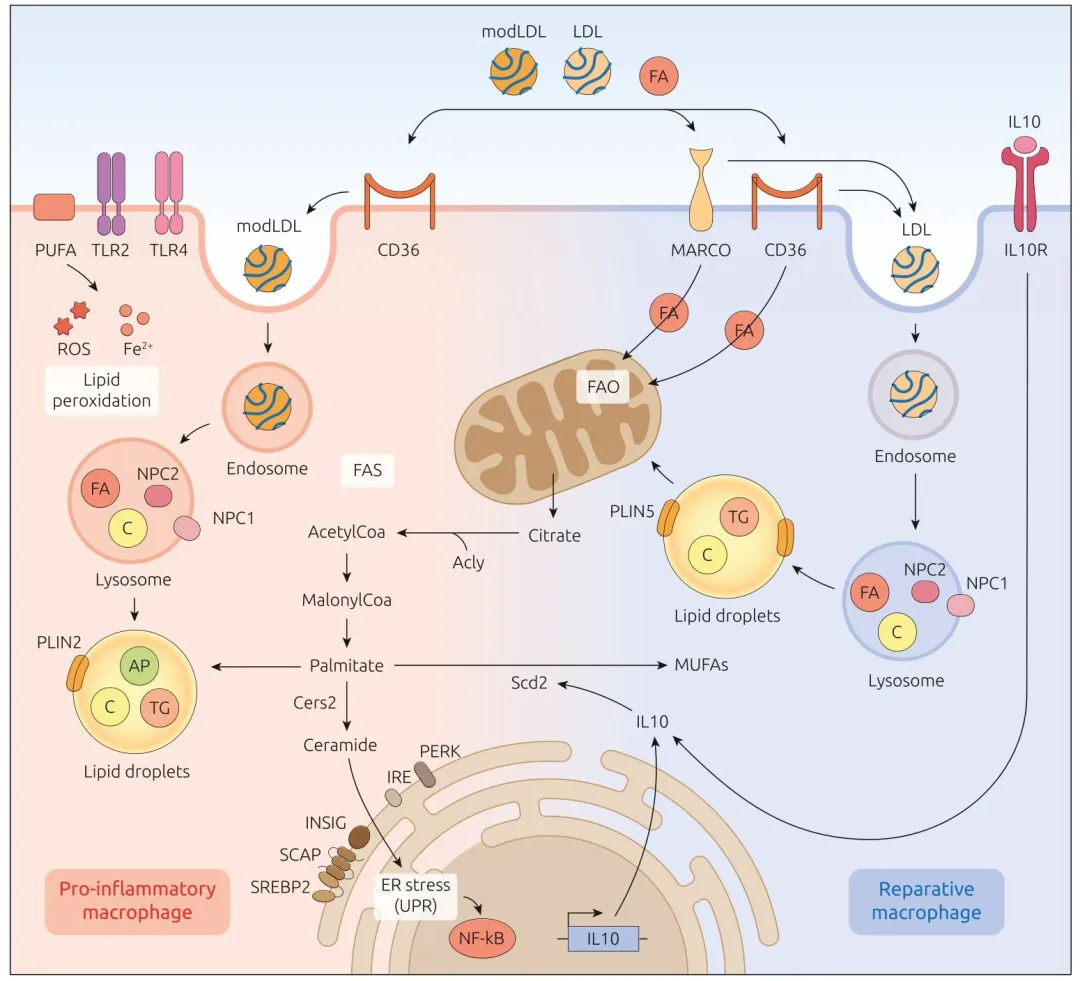
图 1:揭示 M1 样(促炎)与 M2 样(修复型)巨噬细胞的脂质代谢差异,M1 样依赖脂质合成与储存(PLIN2 介导脂滴形成),M2 样依赖线粒体脂肪酸氧化(PLIN5 促进脂滴 - 线粒体互作),IL-10 通过 SCD2 调控脂质代谢参与炎症消退。
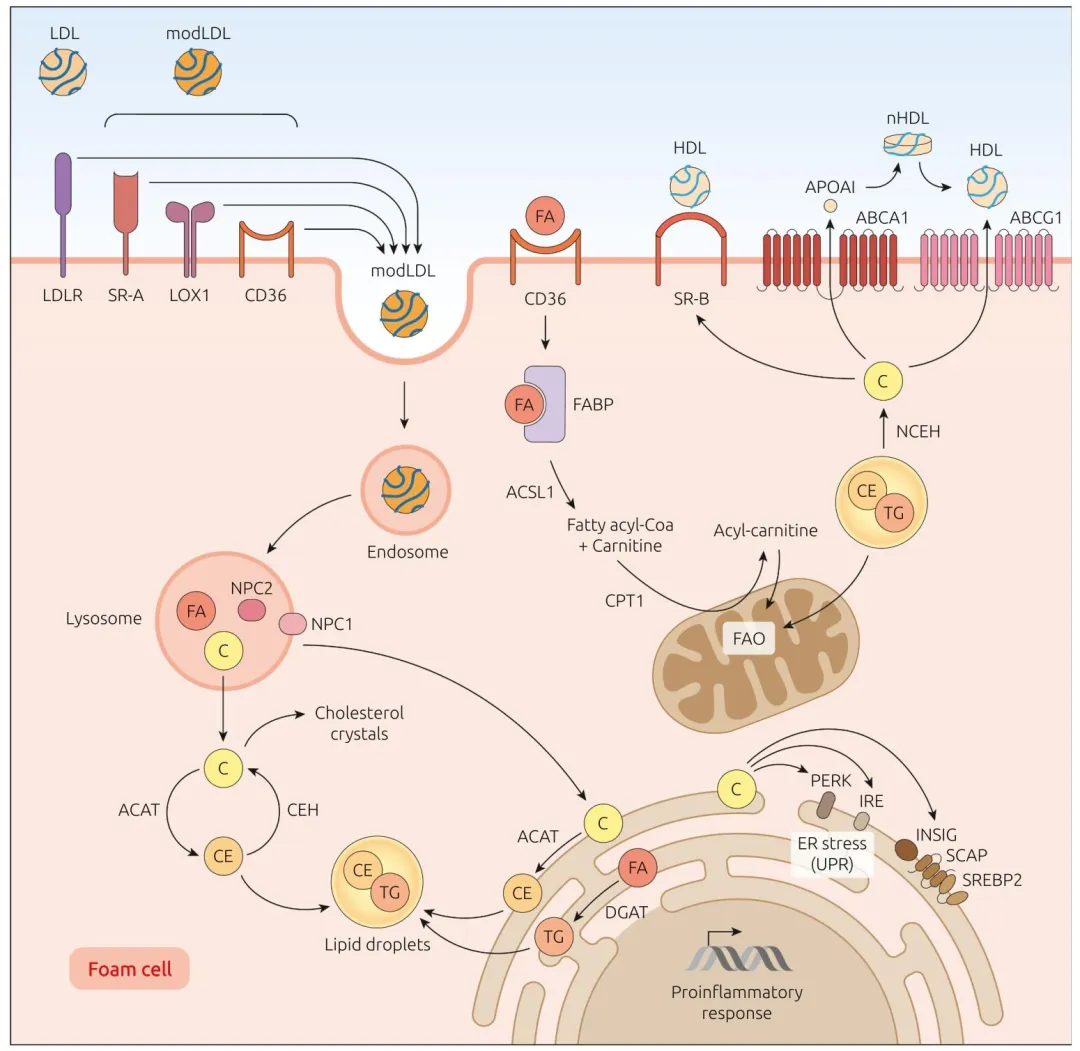
图 2:解析动脉粥样硬化中 FC-Macs 的脂质代谢通路,包括 oxLDL 经 scavenger 受体摄取、溶酶体脂质加工、胆固醇酯储存与外流,胆固醇过载引发内质网应激与炎症激活的分子机制。
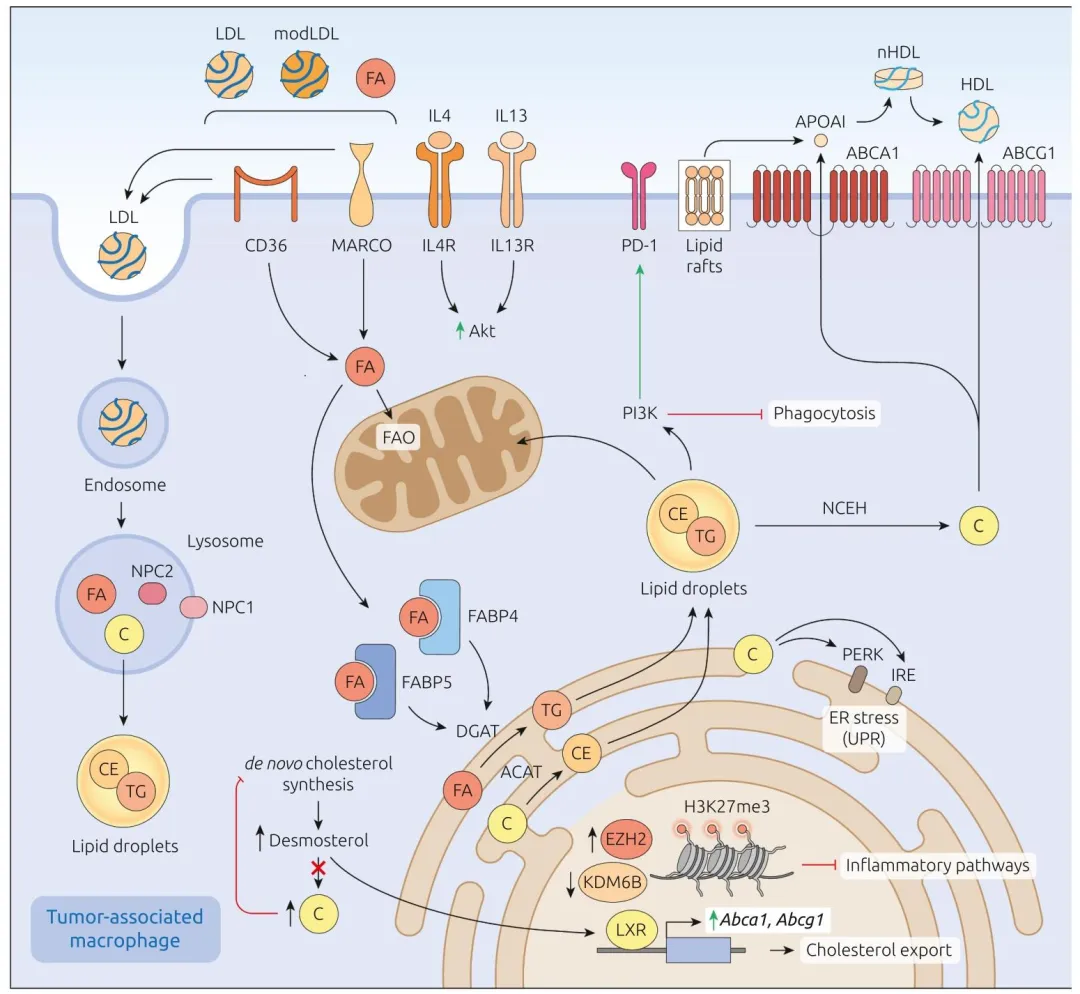
图 3:阐明癌症中 LL-TAMs 的脂质摄取与功能调控,肿瘤来源脂质经 CD36/MARCO 受体进入巨噬细胞,通过 FAO、PPARγ 通路促 M2 样极化,脂质过载激活 PI3K/mTOR 与 PD-L1 信号,同时胆固醇前体激活 LXR 通路促进脂质外流。
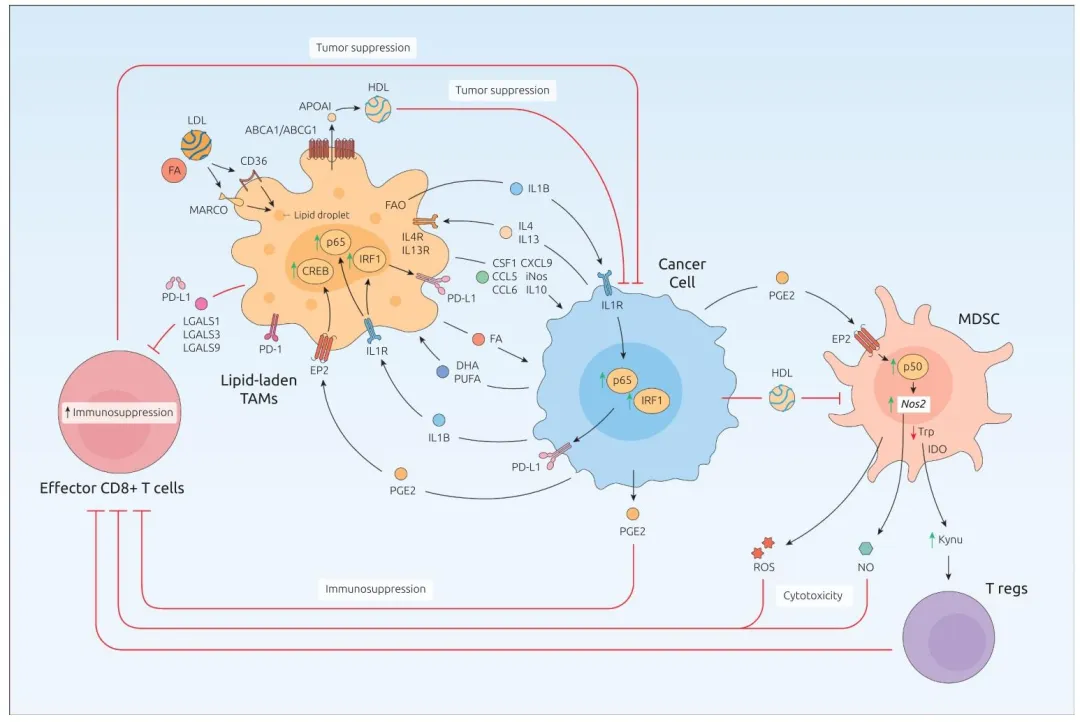
图 4:呈现 LL-TAMs 与肿瘤微环境的互作网络,LL-TAMs 通过分泌 PD-L1、PGE2 抑制 CD8+T 细胞活性,肿瘤细胞分泌脂质与 PGE2 反向促进 LL-TAMs 极化,同时诱导髓系来源抑制细胞(MDSCs)扩增,形成免疫抑制环路。
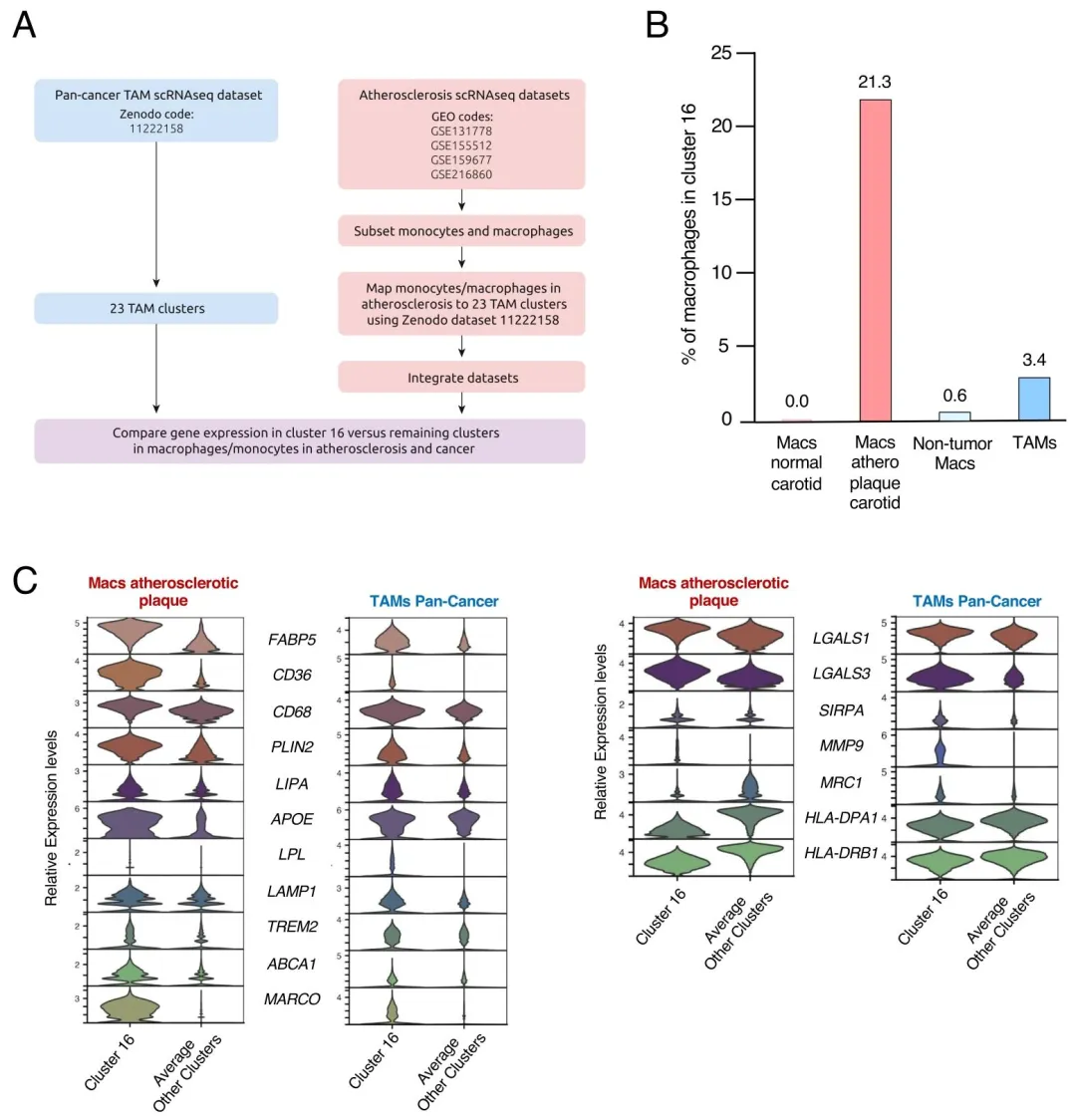
图 5:通过单细胞 RNA 测序数据对比两种疾病中 LL-Macs 的基因表达特征,鉴定出 CD36、FABP5 等共享脂质代谢基因,及 MRC1(LL-TAMs)、MARCO(FC-Macs)等疾病特异性基因,明确 Cluster 16 为两者共有的脂质富集巨噬细胞亚群。
参考文献:Martinez-Campanario MC, Cortés M, Han L, Brischetto A, Rivero-Soriano P, Font-Díaz J, Maurel J, Andrés V, Postigo A. Lipid-laden macrophages in atherosclerosis and cancer. Semin Cancer Biol. 2025 Dec;117:38-56. doi: 10.1016/j.semcancer.2025.09.007. Epub 2025 Sep 24. PMID: 41005549.
本文中使用的图片来Pubmed,因客观原因未能与权利人取得联系。本平台出于学术交流目的引用,无意侵犯原作者权益。如权利人认为不妥,请及时联系公众号后台,我们将立即删除或协商解决。
医学国自然,省自然,博士课题设计,医学实验外包,医学SCI,实验方案设计,免费的线上博导一对一沟通,确认实力后再谈合作,科研合作可以加微信:SCI971SCI

生物信息学课题设计及指导实录,目前生信是否还适用于课题及文章?看专家给你解答
临床型博士如何准备国青标书?没有预实验怎么办?专家一对一解答规划
科研信息合集
整形外科方向最新研究分享
国自然课题设计思路
各大学校及医院国自然立项信息
骨科科研最新分享
泌尿外科科研最新分享
消化领域科研最新分享