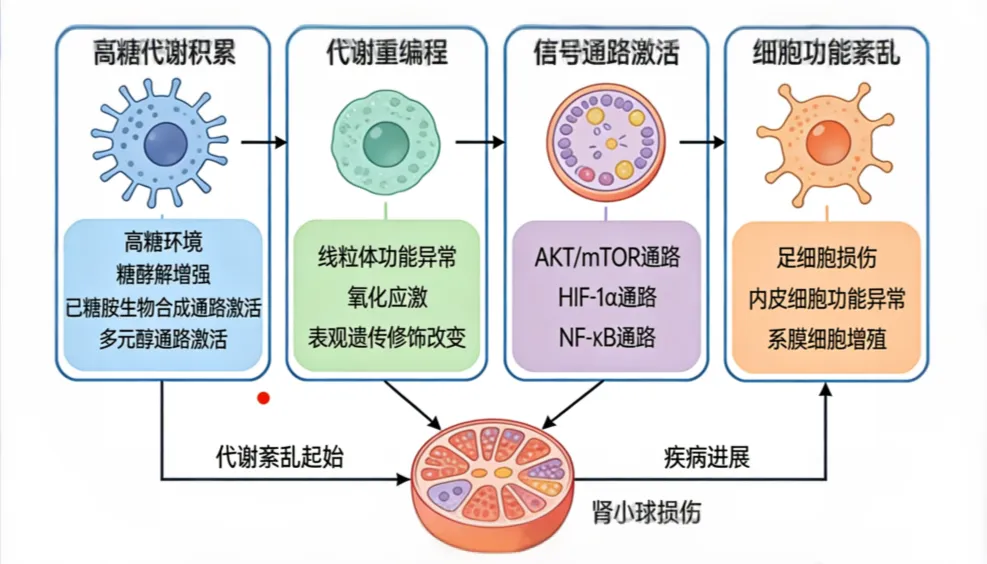
糖尿病肾病(DKD)的本质是高糖环境引发的肾脏细胞代谢紊乱与功能重塑,而高糖驱动的代谢重编程,正是激活多条损伤通路、推动肾脏慢性损伤的核心机制。这种重编程打破了肾脏细胞正常的代谢平衡,让葡萄糖代谢流向异常通路,形成“代谢紊乱-通路激活-组织损伤”的恶性循环,最终导致肾小球硬化与肾功能衰竭。
生理状态下,肾脏细胞的葡萄糖主要通过糖酵解、三羧酸循环等途径完成能量代谢,维持细胞正常生理功能。当机体处于持续高糖状态时,肾小球滤过的葡萄糖大量涌入肾脏固有细胞,超出常规代谢途径的处理能力,细胞会启动代谢重编程:一方面,糖酵解速率异常提升,即使在有氧条件下也优先进行糖酵解供能,形成“瓦博格效应”,导致乳酸等代谢产物蓄积,加重肾脏细胞微环境酸化;另一方面,大量葡萄糖被分流至多元醇通路、己糖胺通路、PKC通路及AGEs合成通路,即经典的高糖损伤四大通路,成为代谢重编程的核心下游效应通路。
代谢重编程是多条损伤通路激活的共同“上游开关”。高糖通过代谢重编程激活多元醇通路,醛糖还原酶催化葡萄糖生成山梨醇,引发细胞渗透压失衡与氧化应激;分流至己糖胺通路的葡萄糖经GFAT催化生成UDP-GlcNAc,导致蛋白异常O-GlcNAc修饰,扰乱信号传导;同时,代谢重编程促进DAG合成,直接激活PKC通路,磷酸化下游靶蛋白破坏滤过屏障;而未被代谢的葡萄糖则与大分子发生非酶促糖基化反应,加速AGEs生成,激活RAGE介导的炎症与纤维化通路。这四大通路并非孤立存在,而是在代谢重编程的调控下相互交联、彼此放大,形成协同损伤效应。
高糖代谢重编程还会引发肾脏细胞的能量代谢紊乱与氧化应激爆发。糖酵解的异常激活会导致线粒体功能受损,三羧酸循环受抑,ATP生成不足,肾脏细胞因能量匮乏出现功能异常;同时,线粒体呼吸链功能紊乱会释放大量活性氧(ROS),而代谢重编程过程中NADPH的大量消耗,会削弱细胞的抗氧化能力,导致ROS无法被及时清除,进而激活NF-κB、JAK-STAT等炎症通路,诱导TNF-α、IL-6等促炎因子释放,加重肾脏局部炎症浸润,同时促进TGF-β、CTGF等促纤维化因子表达,加速细胞外基质沉积。
在足细胞、系膜细胞与肾小管上皮细胞中,代谢重编程的损伤效应各有侧重但相互协同。足细胞中,代谢重编程通过激活多条通路破坏裂孔膜结构,导致足突融合、白蛋白尿;系膜细胞则因代谢重编程出现异常增殖,系膜基质过度扩张;肾小管上皮细胞受重编程影响发生上皮-间质转分化,成为肾脏纤维化的“主力军”。三者的损伤效应叠加,推动DKD从早期微量白蛋白尿逐步进展为大量蛋白尿、肾功能不全。
更关键的是,高糖代谢重编程会形成不可逆的细胞表型重塑,即使后期血糖得到控制,肾脏细胞的异常代谢模式仍难以逆转,这也是DKD呈进行性发展的重要原因。目前,靶向代谢重编程的治疗已成为DKD研究的前沿方向,通过调控糖酵解关键酶、抑制葡萄糖异常分流、修复线粒体功能,可从上游阻断损伤通路的激活,实现对DKD的精准干预。
深入解析高糖驱动的代谢重编程机制,厘清其与下游损伤通路的调控关系,不仅能完善DKD的病理生理认知,更能为开发“从源头阻断损伤”的新型治疗药物提供核心靶点,为延缓甚至逆转DKD进展带来新的突破。