
今天带来的这篇文章由南京大学等多所院校联合发表,围绕“将植物来源细胞外囊泡(EVs)与ROS响应性水凝胶结合,并通过巨噬细胞重编程促进骨折愈合”展开,选题和研究思路都很值得推敲~
选题上,植物EVs在骨修复领域基因层面的靶向机制目前尚不明确,所以,作者针对非愈合、延迟愈合及植物EVs作用时间短、靶向性差等两个层面的问题,设计了这个思路~
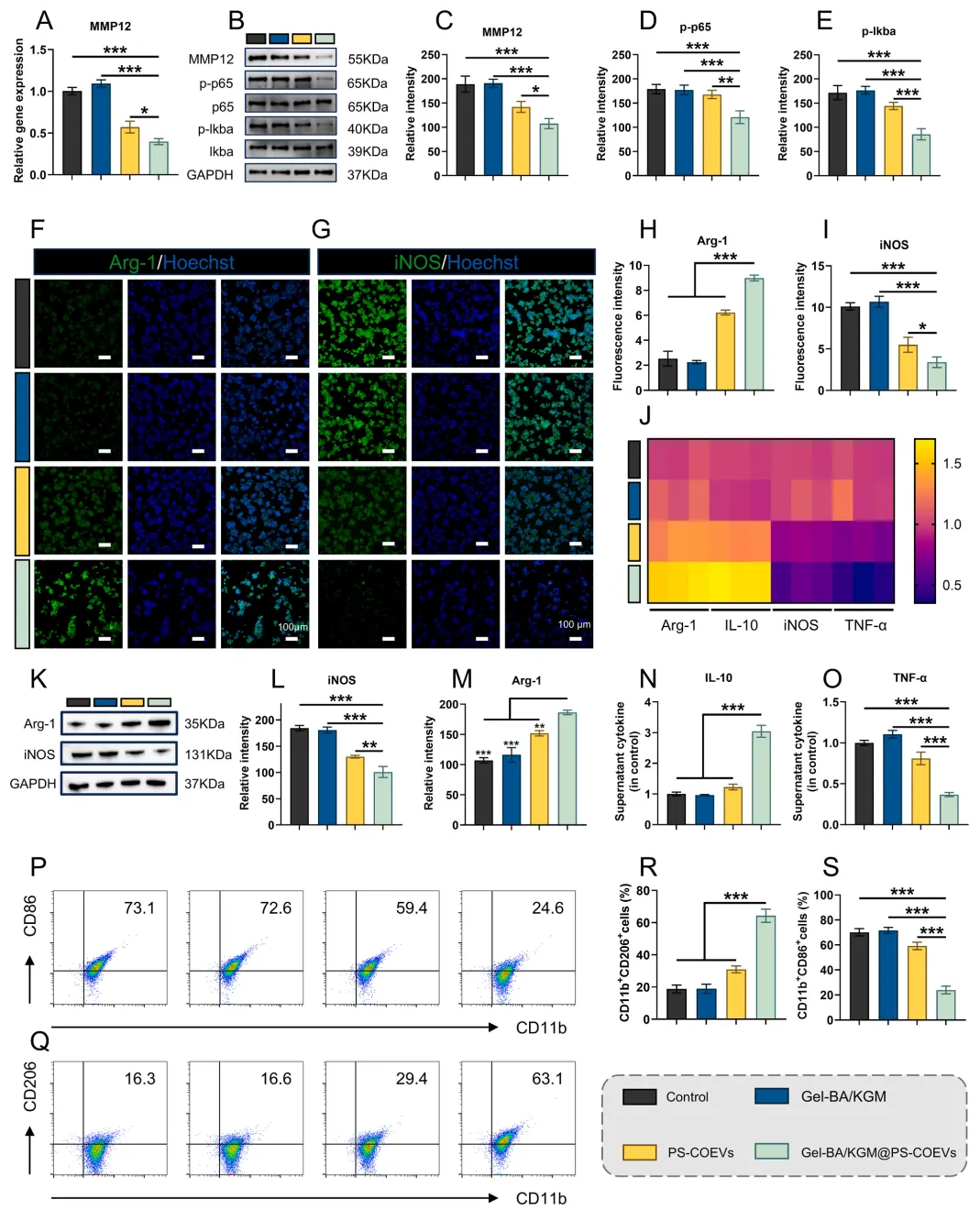
在研究思路方面,这篇文章整合了单细胞数据(公开数据)、网络药理学、组织工程学等多领域技术,从分子机制到体内外验证形成了完整研究链。其中,单细胞和网药部分是最关键的,因为作者是通过单细胞数据分析筛选到了M1 巨噬细胞,然后结合网络药理学锁定 MMP12为核心靶点,明确了MMP12/NF-κB 轴调控巨噬细胞极化的分子路径。这两步是研究进展下去的关键。
这种从生信入手初步筛选机制,再到基础验证的闭环设计,非常符合国自然“机制研究”的高分要求,大家可以模仿学习。对胞外囊泡相关思路感兴趣,但思路设计还没成形的朋友,可以随时滴滴大仲协助选题以及思路设计!

骨折愈合是一个复杂的过程,常伴有骨不连和延迟愈合,而巨噬细胞极化是炎症和组织修复的关键调节因子。单细胞RNA测序(scRNA-seq)已经鉴定出在骨折部位M1型巨噬细胞高表达的基因,这些基因与巨噬细胞极化密切相关。植物源性细胞外囊泡(COEVs)已显示出作为抗炎剂的潜力,但受作用时间短和靶向性差的限制。
设计思路
1、首先通过单细胞数据(GSE217792)阐明了骨折愈合过程中炎症免疫微环境中M1型巨噬细胞极化的机制。
2、随后通过网络药理学的整合,发现MMP12是COEVs中的一个靶点,可以在骨折愈合过程中调节巨噬细胞极化。
3、通过体外实验验证COEVs对靶点的调节作用及其在巨噬细胞极化中的重编程作用。
4、为了解决作用时间短和COEVs靶向性差的局限性,设计了一种通过PS(磷脂酰丝氨酸)修饰的包封COEVs的ROS响应性水凝胶(Gel-BA/KGM)。
5、对该水凝胶的微观结构、机械性能、可注射性、自修复性、溶胀性和黏附性,以及其ROS响应性和植物EVs的释放行为进行了综合评估。
6、通过体外实验验证 Gel-BA/KGM@PS-COEVs 对 M1 巨噬细胞向 M2 表型转化的调控作用,以及对骨髓间充质干细胞(BMSCs)成骨分化的促进效果。
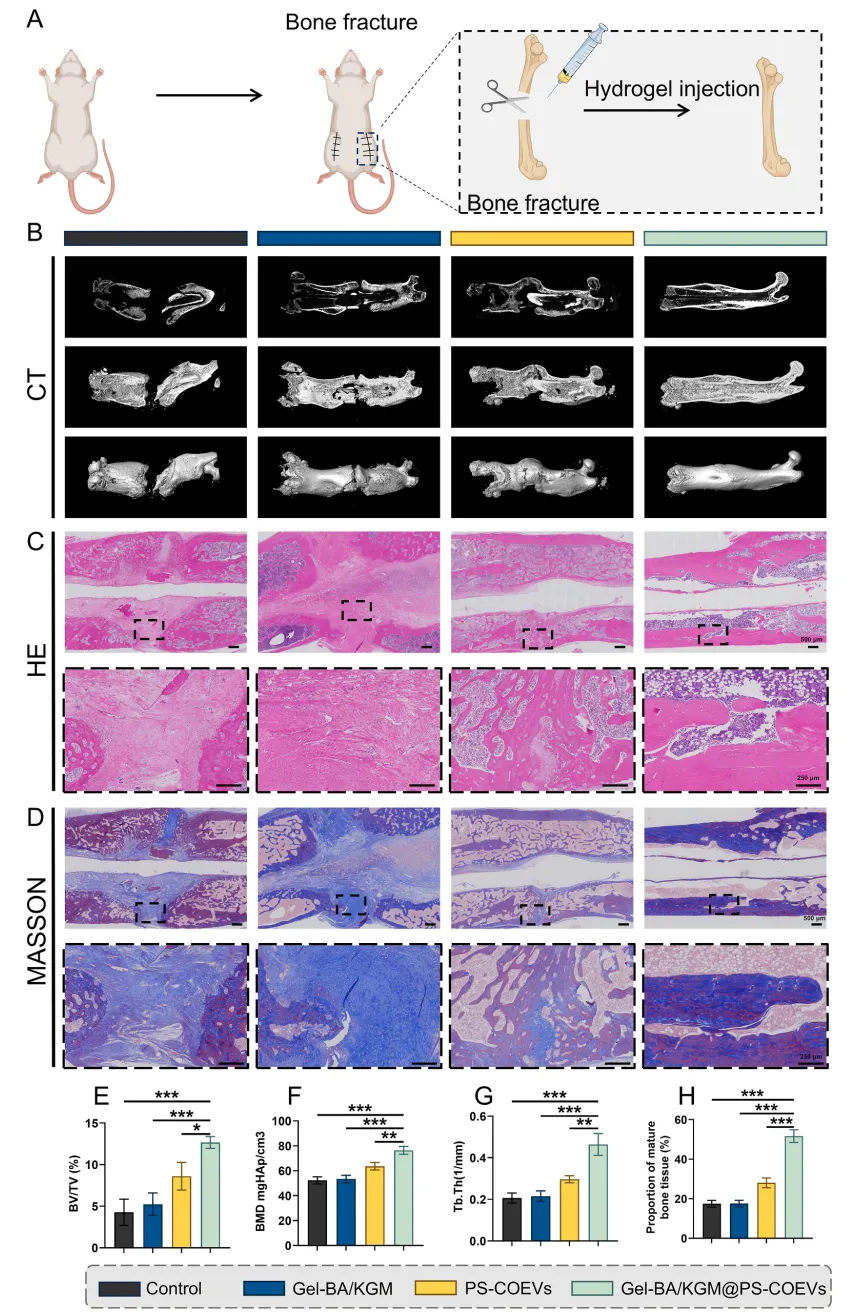
7、在大鼠股骨骨折模型中,通过微CT、组织学染色、免疫组化等技术,评估骨修复效果、巨噬细胞极化状态及成骨标志物表达。
8、通过细胞毒性、溶血实验、体内器官组织学分析及血液生化检测,确认制剂的生物相容性和安全性。
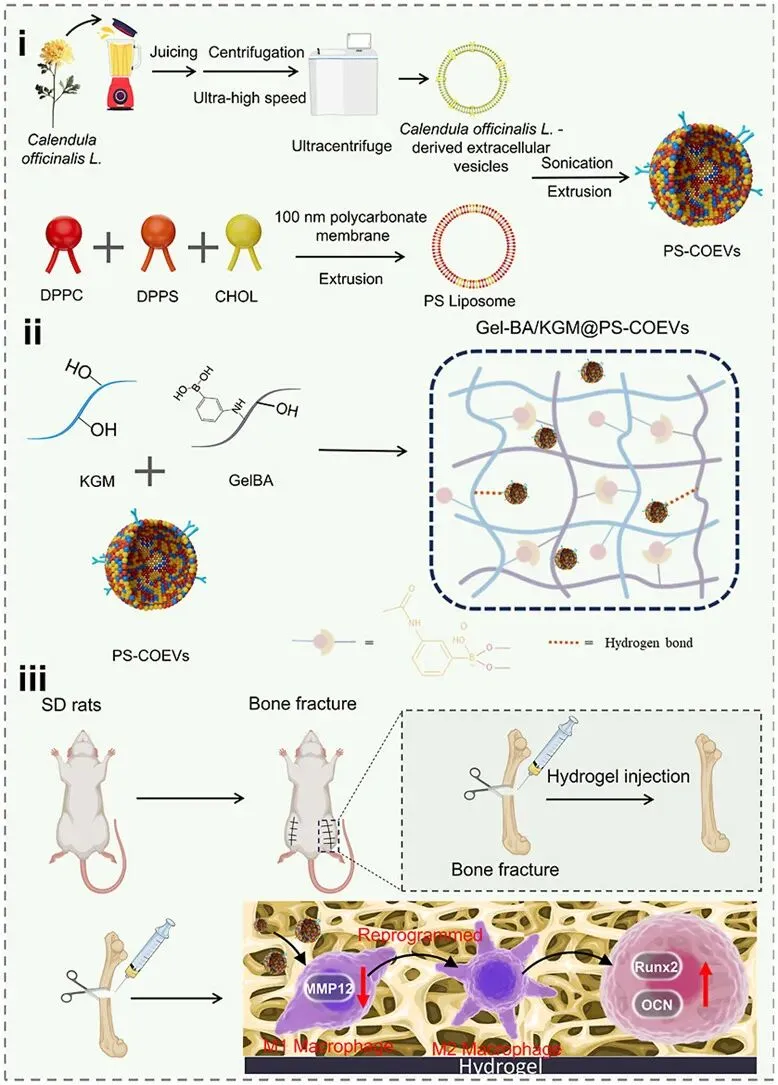
主要结果
单细胞数据分析表明M1 巨噬细胞为关键调控细胞,在不愈合骨折中,M1型巨噬细胞表现出增强的促炎信号,这可能导致持续的炎症和受损的骨折愈合。
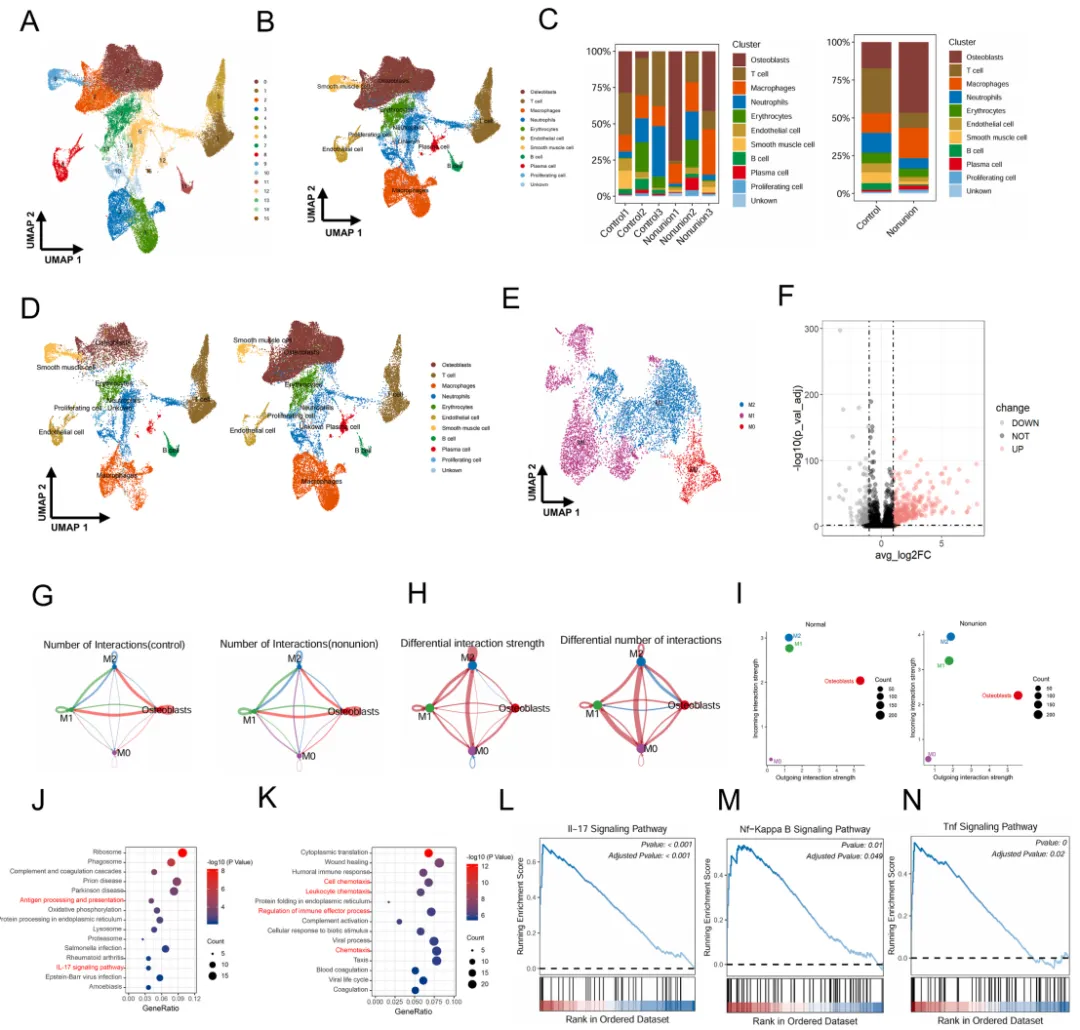
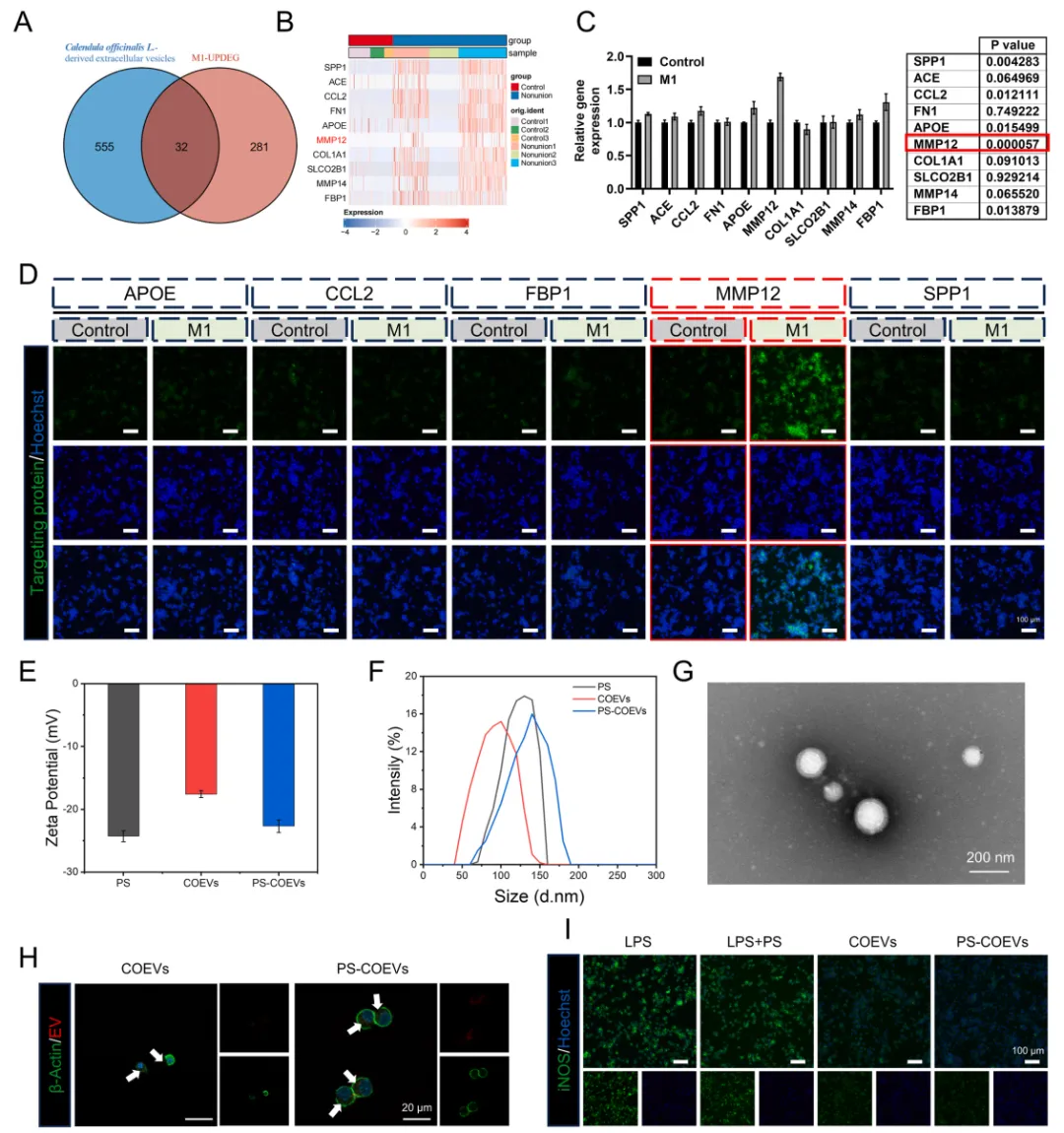
通过网络药理学鉴定出MMP12是由金盏花来源的EVs(COEVs)调控的靶点,MMP12很可能是COEVs调控M1巨噬细胞功能的靶点。对 COEVs 进行PS修饰后,PS COEVs在调控M1巨噬细胞重编程方面具有更强的能力。
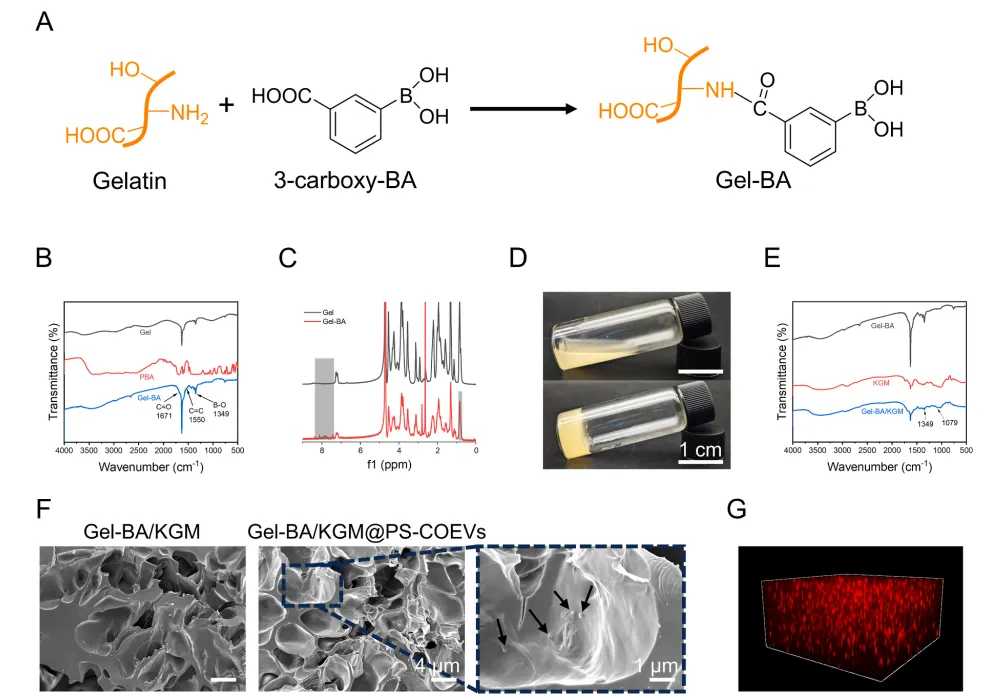
为了增强COEVs的治疗潜力,开发了一种ROS响应性水凝胶,该水凝胶包裹了PS修饰的COEVs,用于巨噬细胞靶向。该水凝胶表现出优异的机械性能、可注射性、自修复性和ROS响应性。
体外实验表明Gel-BA/KGM@PS-COEV沉默MMP12,从而减弱NF-κB信号,引导M1巨噬细胞趋向抗炎的M2表型。
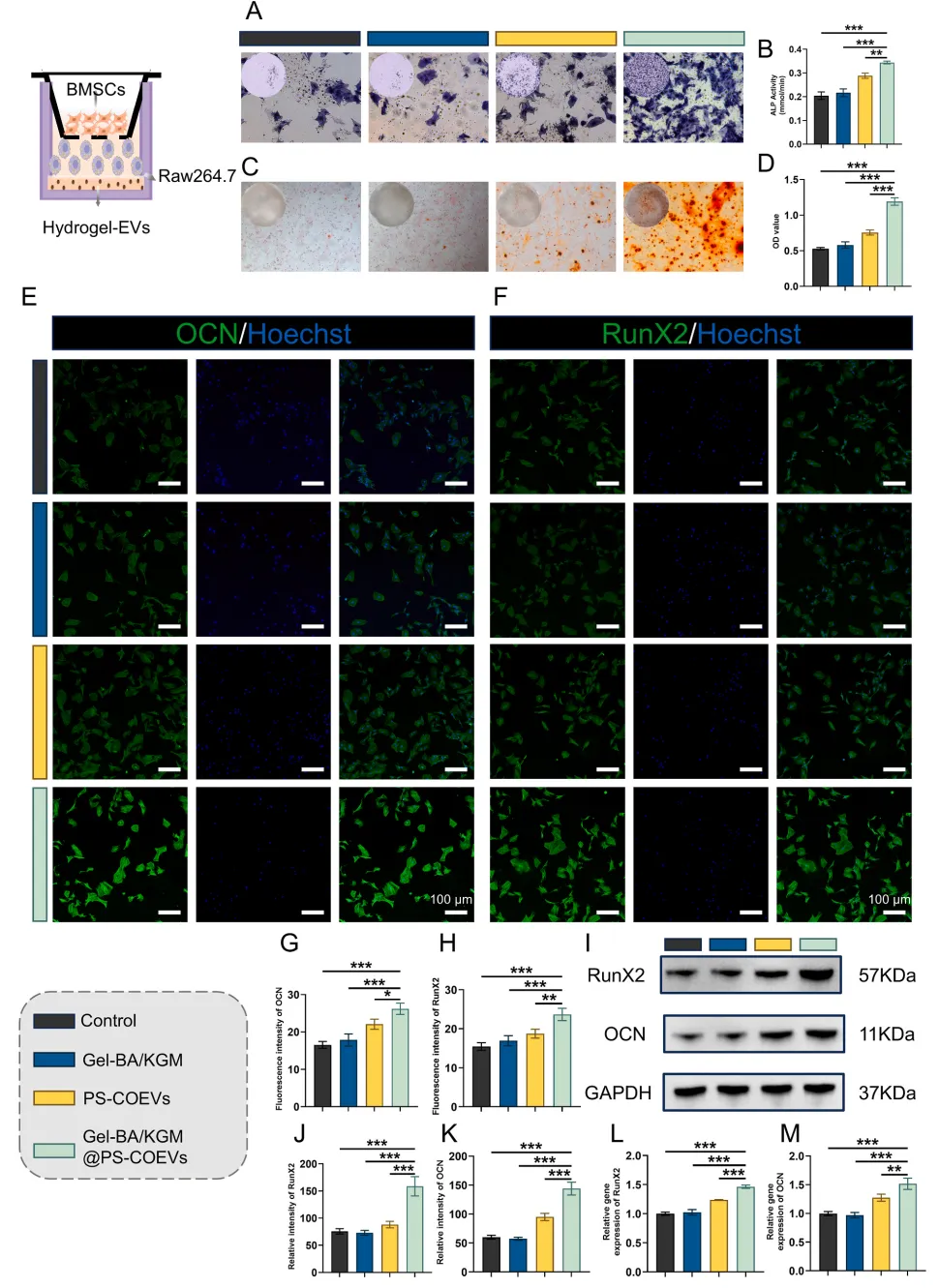
为进一步阐明Gel-BA/KGM@PS-COEVs介导巨噬细胞调节对BMSCs骨生成行为的影响,采用了细胞共培养系统。结果表明Gel-BA/KGM@PS-COEVs-介导的巨噬细胞调控不仅增强了BMSCs的成骨潜能,而且为骨形成提供了一个有利的微环境。
体内外实验进一步证实了Gel-BA/KGM@PS-COEVs的生物相容性、调控靶基因、巨噬细胞重编程和促进成骨的能力,为骨折修复提供了一种新的治疗方法。
大仲点评
这篇文章通过单细胞初步分析骨折部位的免疫微环境,明确巨噬细胞与成骨细胞的异常相互作用,通过网药确定关键靶点和通路,最后通过体内外验证进行多维度的评估,层层递进,确实是一篇非常值得学习的文章。大仲之前分享过转录组+网药筛选机制的思路,而从单细胞角度设计的比较少,喜欢这个思路的朋友,抓紧行动起来,有需要随时滴滴大仲,选题→思路设计→生信分析,好本子团队一一帮你完成~