Nature Medicine生信代码和input数据 |唐氏综合征胎儿大脑皮层单细胞图谱
- 2026-01-20 19:17:45
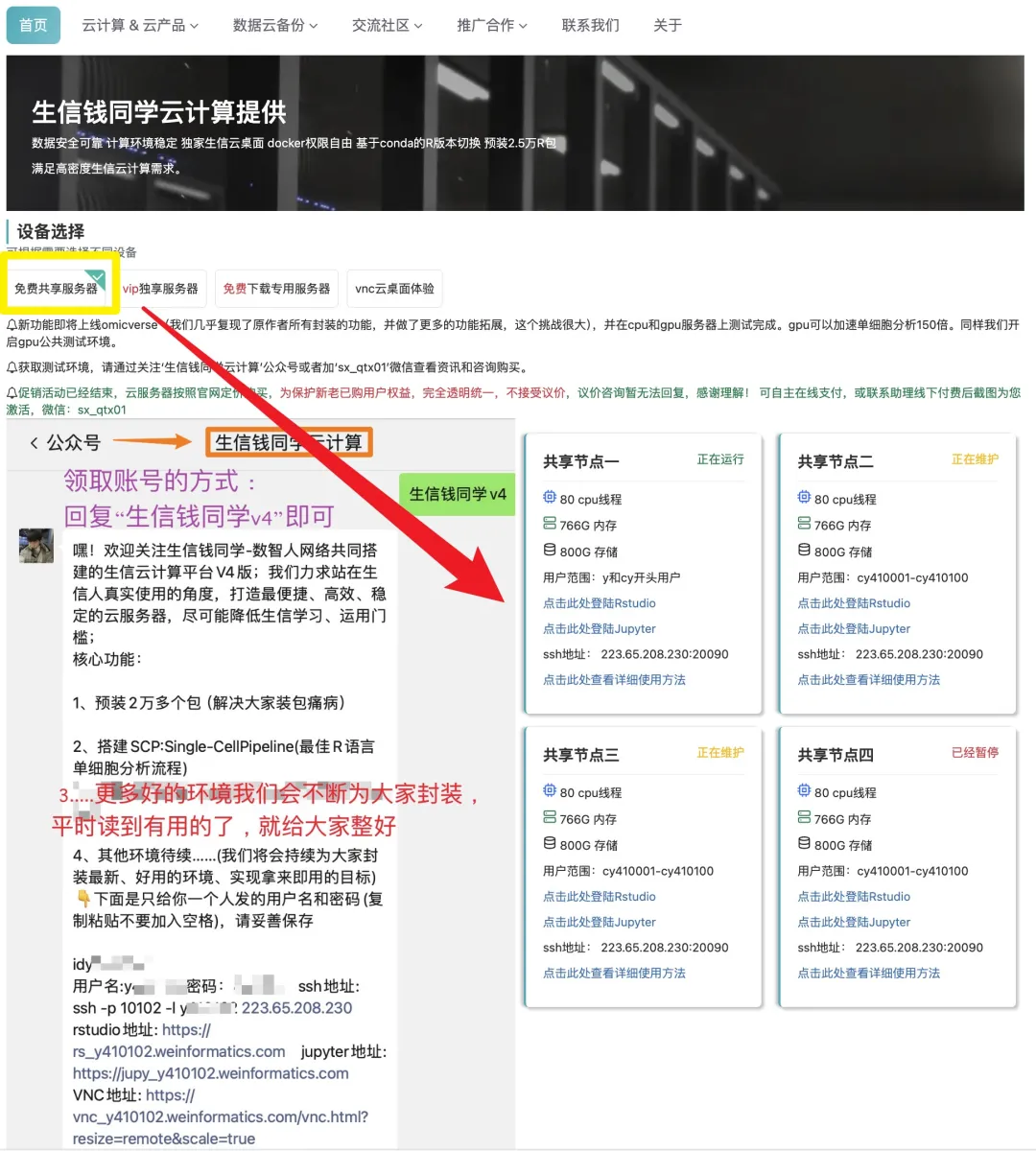
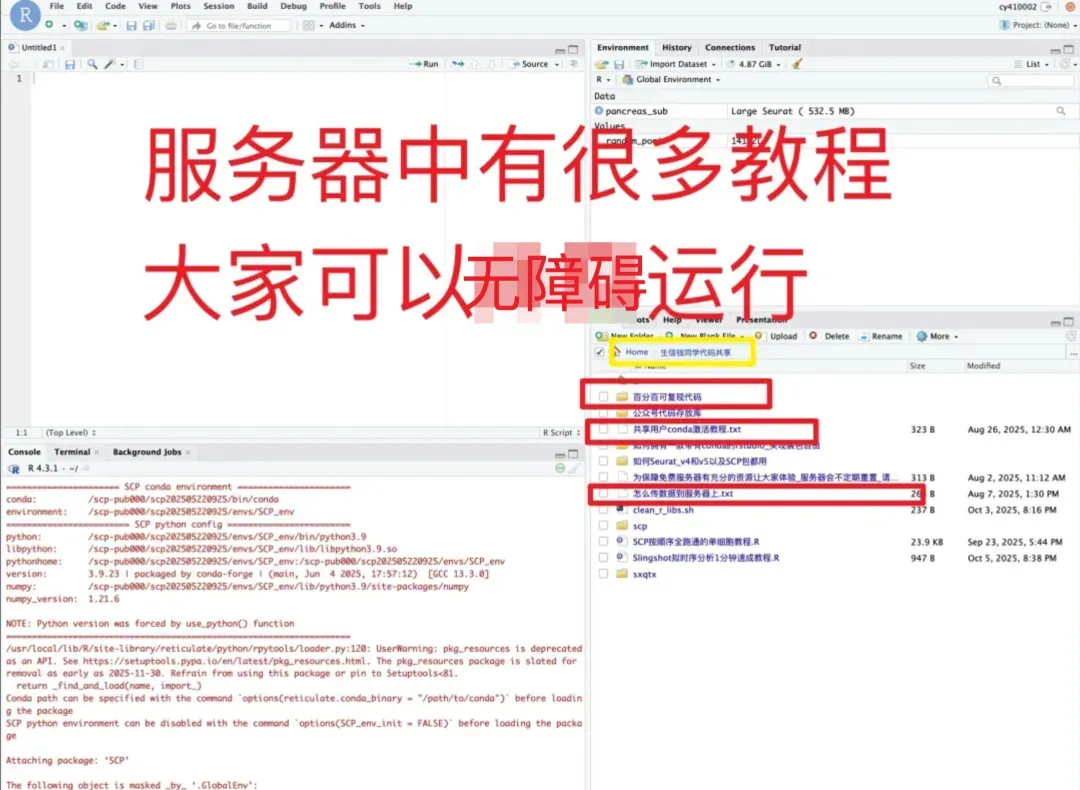
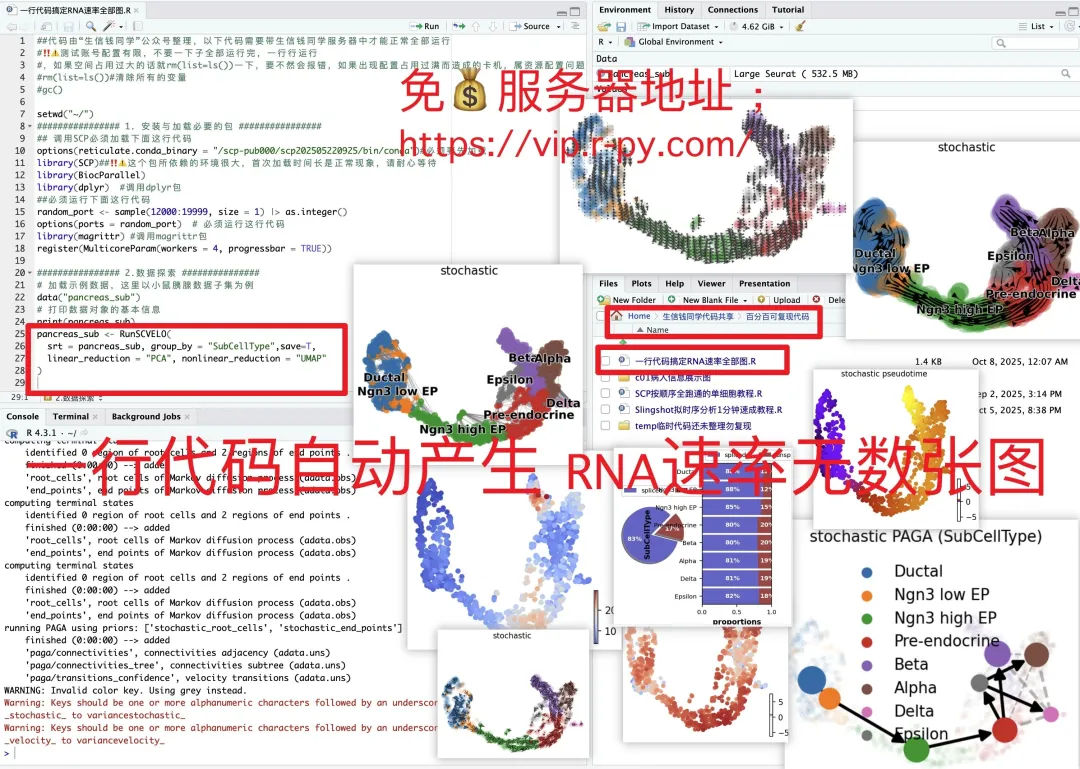
日常好的代码已放入免💰共享服务器中(人人皆可用):https://vip.r-py.com/
突破性研究绘制唐氏综合征胎儿大脑皮层单细胞图谱 揭示神经发育异常核心机制
近日,国际顶尖期刊《自然・医学》(Nature Medicine)在线发表了一项关于唐氏综合征(DS)脑发育机制的突破性研究。来自英国帝国理工学院、新加坡杜克 - 新加坡国立大学医学院等机构的研究团队,通过单细胞多组学技术,首次构建了唐氏综合征胎儿大脑皮层的单细胞图谱,揭示了导致该疾病智力障碍的早期分子和细胞异常,为开发针对性治疗策略提供了关键靶点。


唐氏综合征由 21 号染色体三体(Ts21)引起,是人类最常见的遗传性智力障碍病因,全球每 700 名新生儿中约有 1 例患病。尽管已知该病会导致胎儿脑发育异常,但具体的细胞和分子机制长期不明,目前尚无有效治疗手段。
研究团队对 15 例唐氏综合征和 15 例正常对照的人类胎儿大脑皮层样本(孕 10-20 周)进行了单细胞转录组和染色质可及性分析,成功捕获了近 25 万个高质量细胞。这一时期是人类大脑皮层神经元生成的关键阶段,对大脑结构和功能形成至关重要。
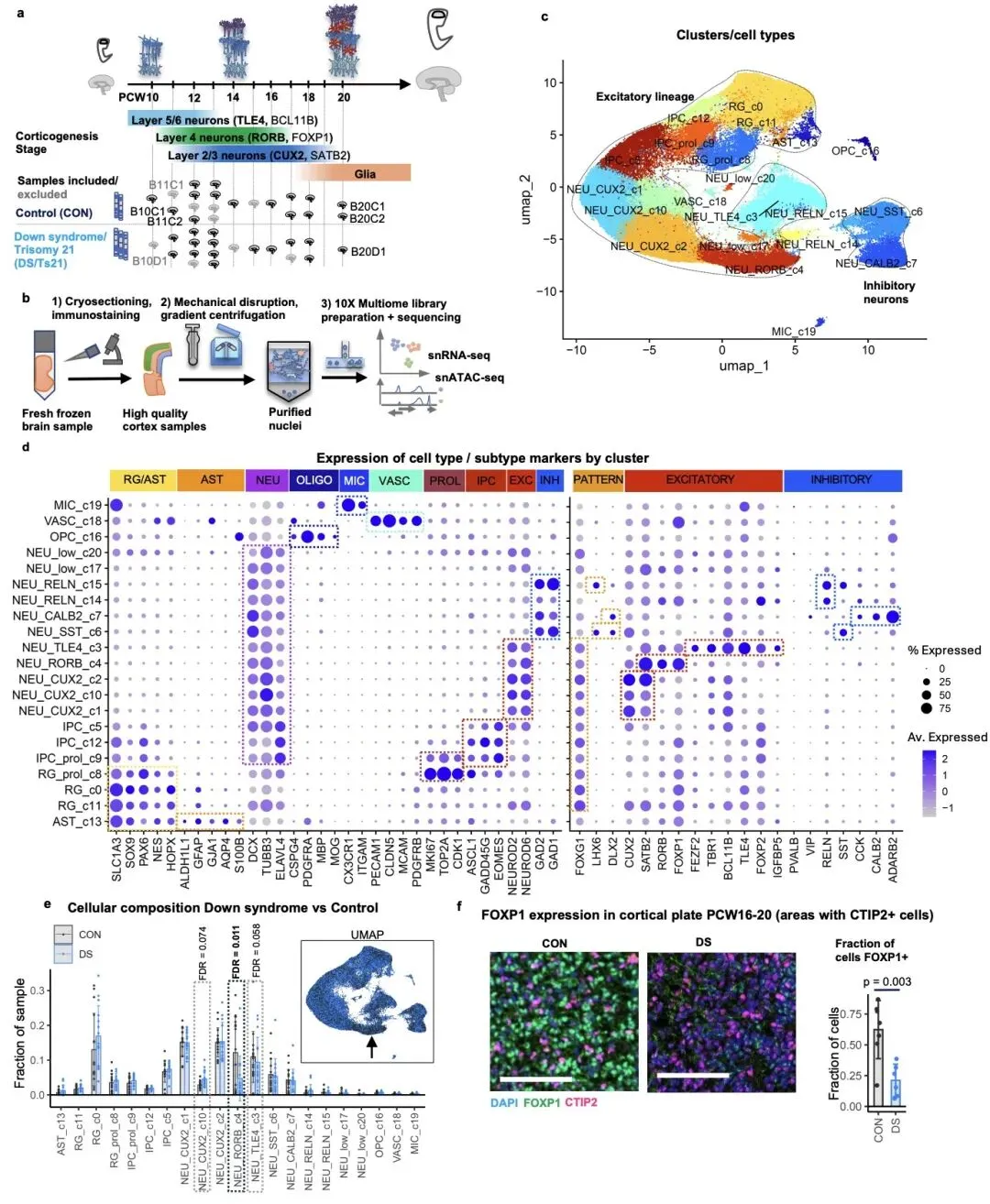
研究的核心发现之一是,唐氏综合征胎儿大脑皮层中表达 RORB/FOXP1 的四层兴奋性神经元亚型显著减少,这一现象在发育晚期(孕 16-20 周)尤为明显。通过免疫染色和独立分析方法验证,确认该细胞亚群的缺失是唐氏综合征胎儿脑发育的早期关键表型。值得注意的是,这一细胞缺陷此前仅在成年唐氏综合征患者和阿尔茨海默病患者中被报道,提示该异常可能从胎儿期持续至成年,是导致认知障碍的重要原因。
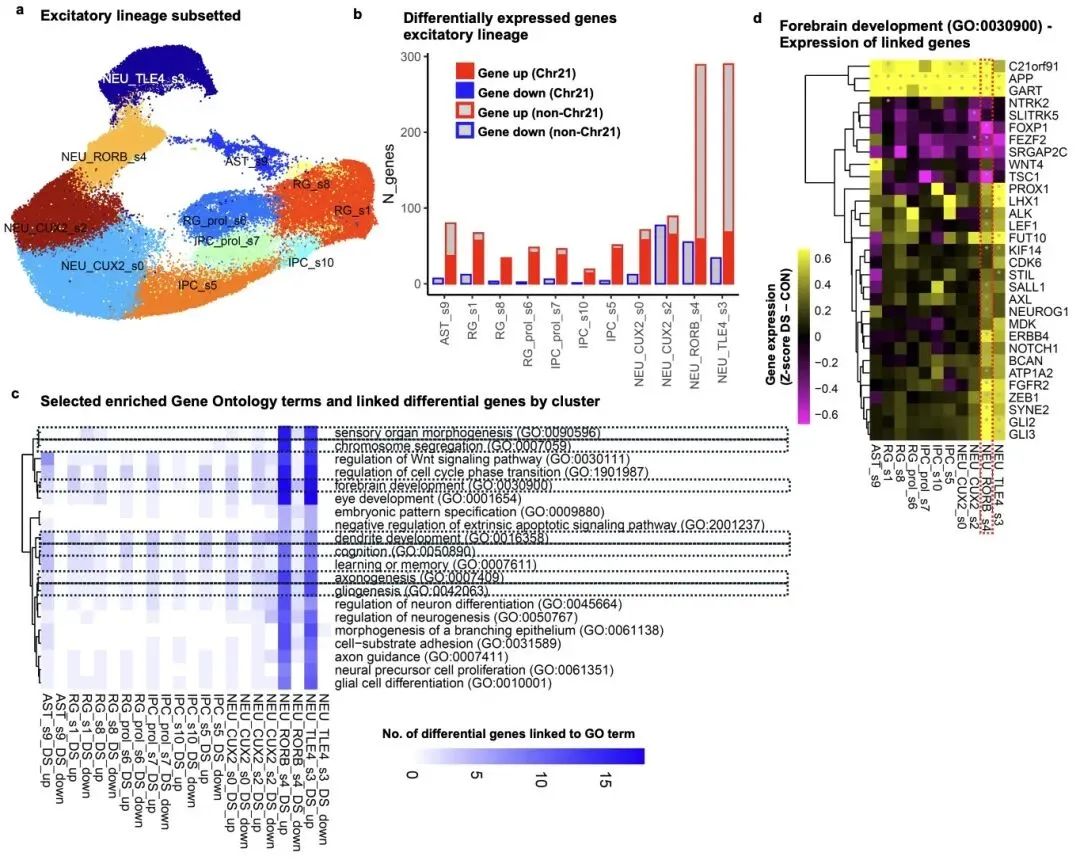
进一步的分子机制分析显示,唐氏综合征胎儿大脑存在广泛的神经发育转录程序紊乱,共鉴定出约 700 个差异表达基因,这些基因主要富集于前脑发育、神经元分化、轴突发生和树突发育等关键生物学过程。其中,21 号染色体上的三个转录因子 BACH1、PKNOX1 和 GABPA 被证实为剂量敏感的调控枢纽,它们直接调控 80 余个与智力障碍相关的靶基因,包括 FOXP1、FEZF2 等神经发育关键因子。
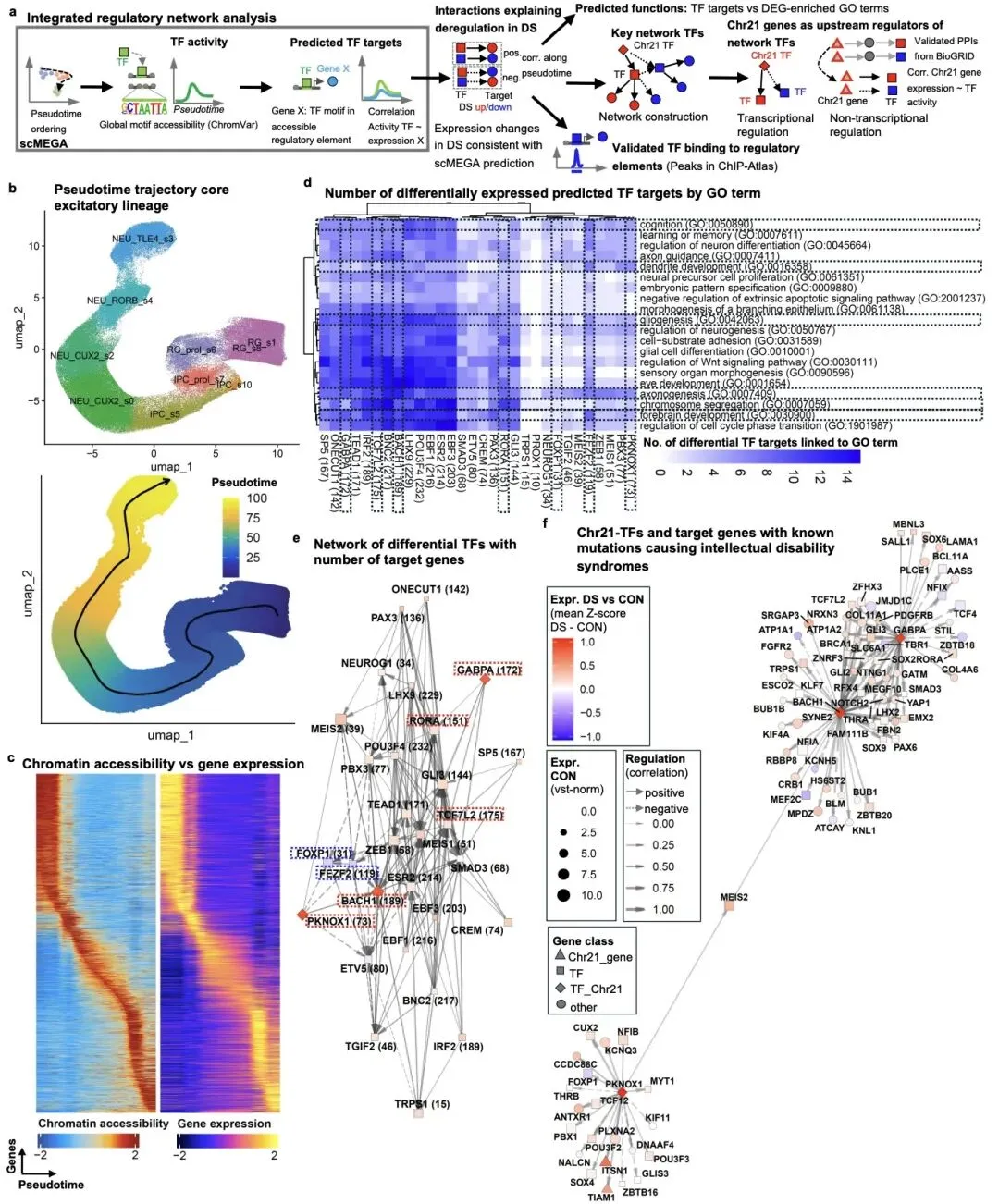
研究还发现,这些转录因子通过直接调控或蛋白质相互作用网络,与 DYRK1A、APP 等已知唐氏综合征相关基因协同作用,共同扰乱神经发育程序。令人振奋的是,研究团队利用反义寡核苷酸(ASO)技术在人诱导多能干细胞(iPSC)衍生的神经祖细胞中,成功将这三个转录因子的表达水平恢复至正常水平,并部分挽救了下游靶基因的异常表达,包括多个智力障碍相关基因。
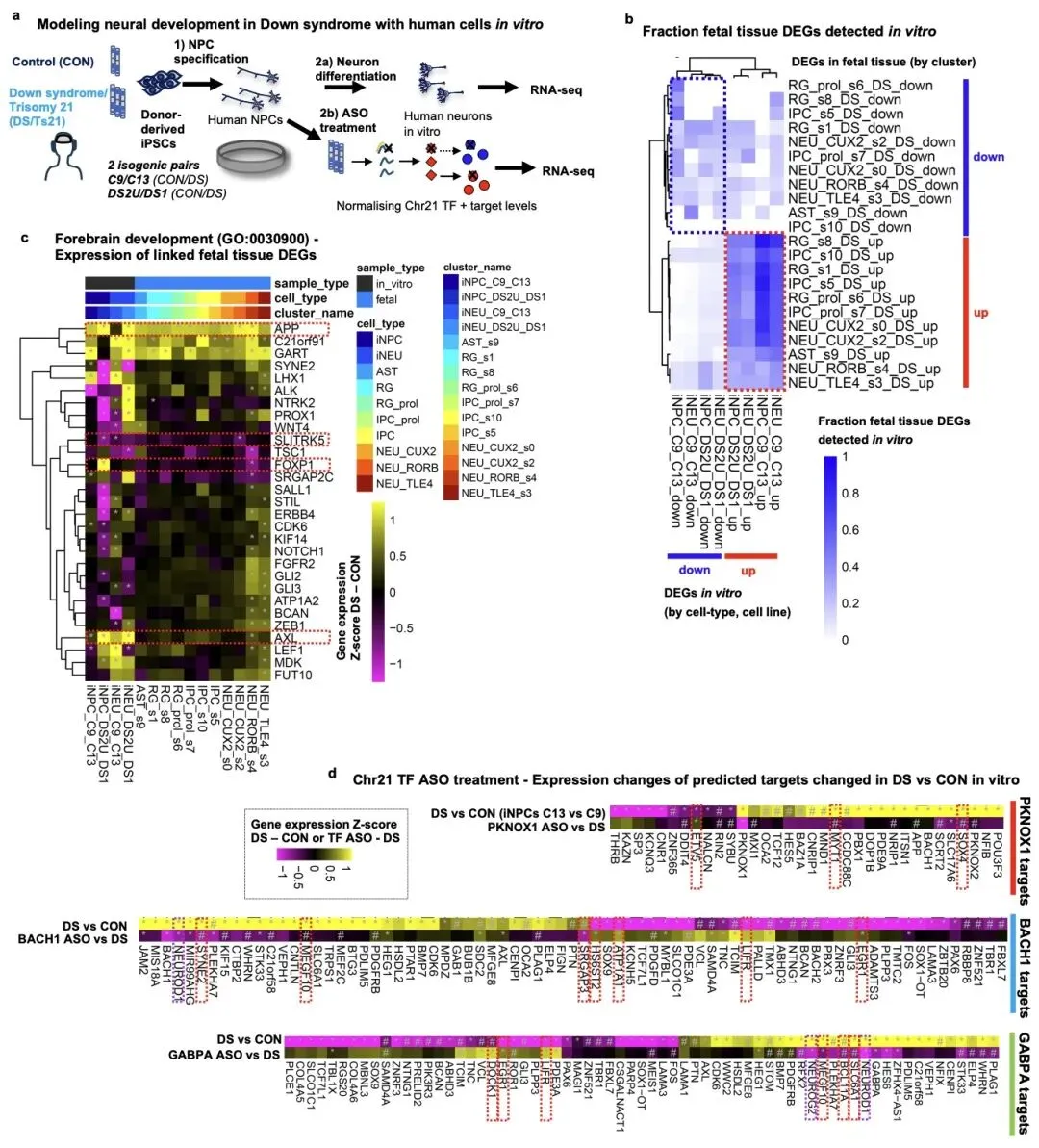
为全面验证研究发现,团队建立了体外 iPSC 模型和体内异种移植模型。结果显示,iPSC 衍生的神经细胞能够重现唐氏综合征的核心分子表型,而异种移植模型则捕获了更多晚期发育阶段的细胞和分子特征,包括星形胶质细胞增多、增殖祖细胞减少等表型,弥补了体外模型的局限性。这两种模型的结合为后续药物研发提供了强大的研究平台。
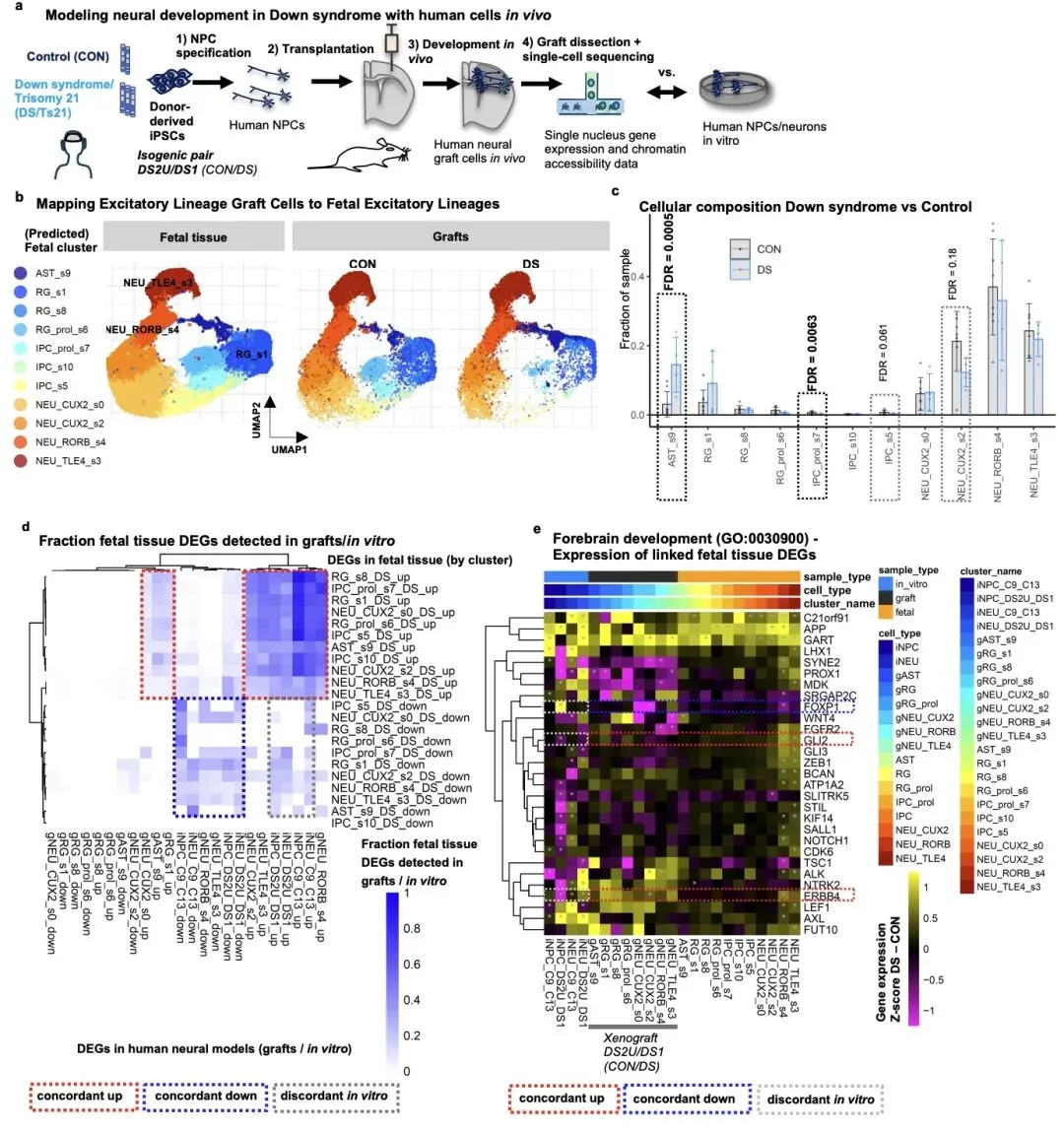
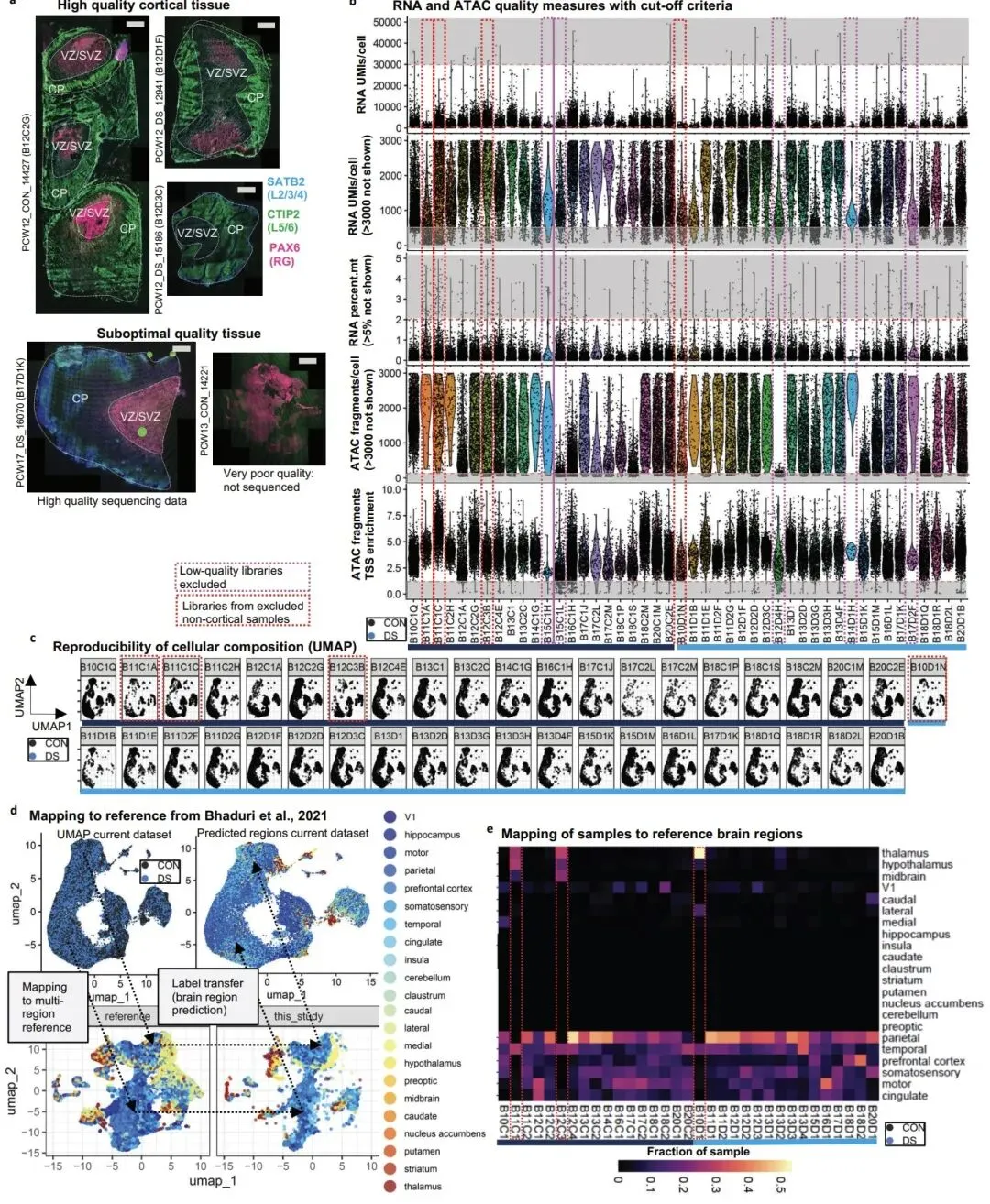
这项工作首次在单细胞分辨率下揭示了唐氏综合征胎儿脑发育异常的分子蓝图,明确了 21 号染色体转录因子作为关键调控节点的作用。研究构建的公开可用数据集,为全球研究人员提供了宝贵的资源,将加速唐氏综合征神经发育机制研究和治疗靶点验证。
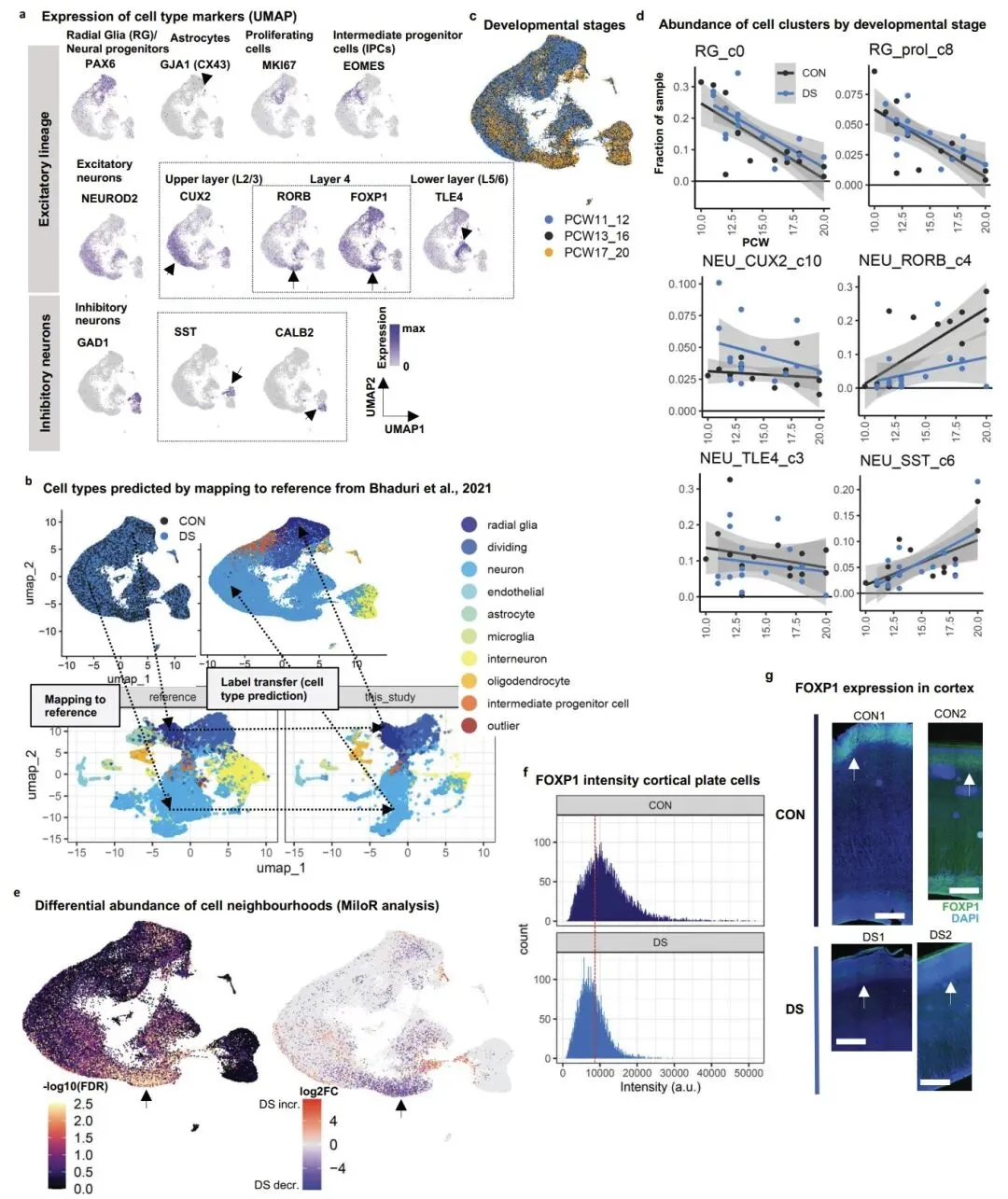
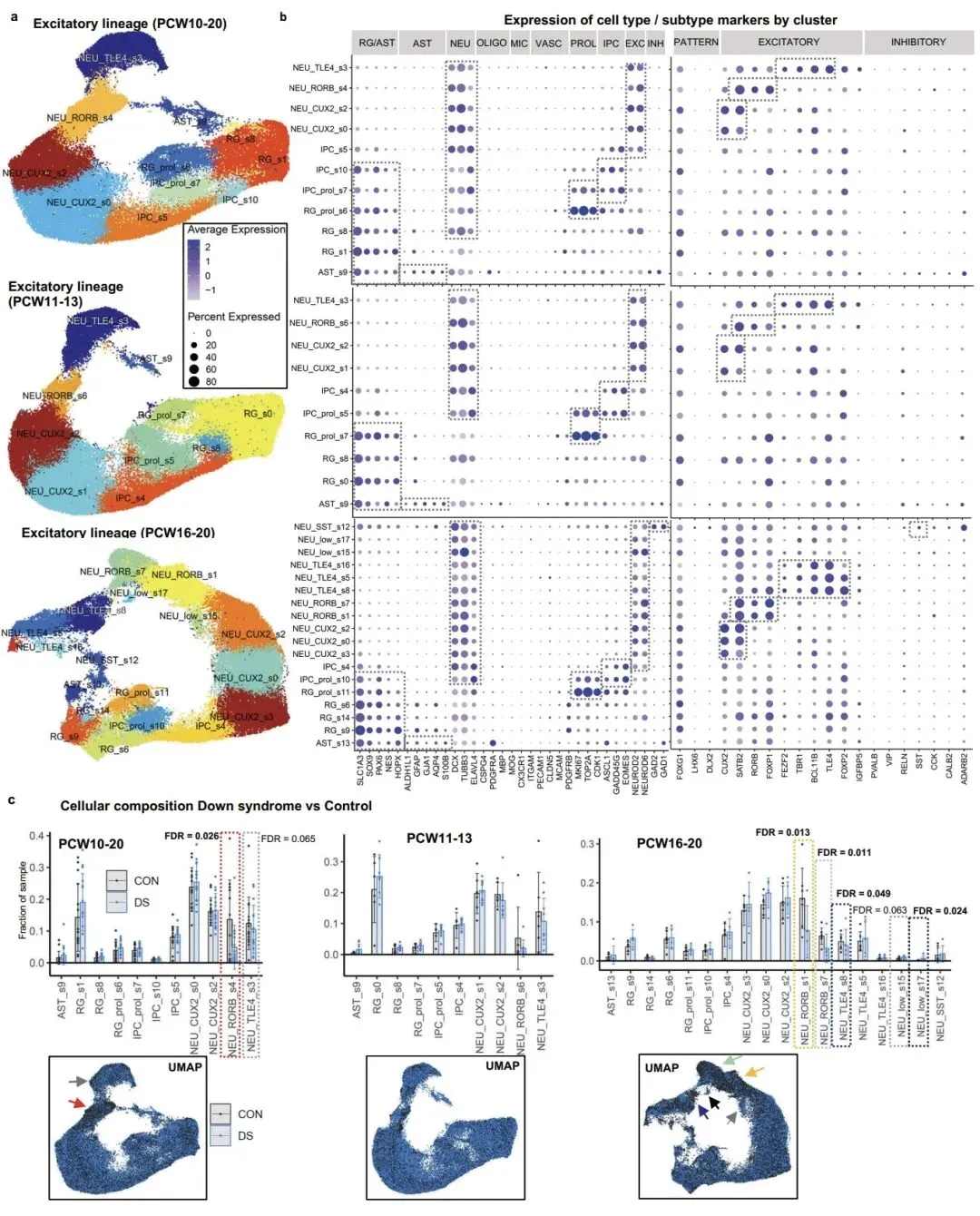
该研究不仅加深了对唐氏综合征脑发育异常的理解,更重要的是发现了可被靶向调控的关键转录因子,为开发基于反义寡核苷酸或小分子药物的精准治疗策略奠定了基础。
(我们自己开发的服务器,很多意想不到的功能
免💰服务器地址:https://vip.r-py.com/)
生信钱同学团队提供生信便捷式“云服务器”、“数据分析”、“生信学习班”以及“生信交流群”等内容,有需要者可以加我:sx_qtx01
相关推文内容:
今天开课了,没服务器直接送——多组学与机器学习联合分析(机器学习分析代谢组、蛋白组、宏基因组、网络药理学、转录组课)
学生信当然要与时俱进了,零基础也能学的AI生信课(AI助力生信入门班即将开始(AI课)
超多生信内容学习,感兴趣可以了解下(单细胞课程)
没有服务器,单细胞数据搞不定?看看我们做出来的结果包含啥?我们目前做好了这些pipeline,可以帮你做(数据分析) 公共共享服务器已开启,无门槛尽管用,不限制资源(免💰服务器) 今晚 7 点开始,12节线上课,不收费,把开源的QuPath病理和荧光图像分析的技巧学明白 手把手复现Nature的生信教学即将开始,感兴趣的可以了解下 当我同学用这个套路发了10几篇SCI,并拿了国奖,我惊呆了——文献计量学+AI大语言模型学习(文献计量培训) Gemini详细安装教程,自动分析数据,不是器械式写代码,而是帮你做好,就是这么智能(AI自动写代码,自动分析数据)