Science | 突破体外神经元编程瓶颈!480种组合+70万单细胞解析,构建人类神经元亚型“百科全书”
- 2026-02-08 02:30:17

生命科学进展
人类神经元编程通过转录因子(TF)过表达模拟神经元分化和疾病。然而,在体外可编程的神经元亚型的多样性仍未得到解决。
2025年7月10日,瑞士苏黎世联邦理工学院Barbara Treutlein团队在Science 在线发表题为“Human neuron subtype programming via single-cell transcriptome-coupled patterning screens”的研究论文,该研究调节发育信号通路并结合TF过表达来探索多能干细胞产生的神经元亚型谱。
该研究使用多路单细胞转录组读出筛选了480种与TF诱导相结合的形态因子信号调节。对70万个细胞的分析确定了沿神经管发育轴分布的各种兴奋性和抑制性神经元。在TF过表达之前对神经祖细胞进行模式化,通过激活在原代组织对应物中活跃的调控,扩大了神经元的多样性。总之,该研究的方法为编程不同的人类细胞亚型以及研究合作信号如何驱动神经元命运提供了一种策略。
人类兴奋性和抑制性神经元可以通过体外诱导多能干细胞(PSCs)表达先驱转录因子来诱导。这些诱导神经元(iNs)被广泛用于研究神经发育、分化和神经系统疾病,如阿尔茨海默病、帕金森病和肌萎缩侧索硬化症。此外,程序化神经元显示出细胞替代疗法在神经损伤后恢复功能的前景。扩大神经元类型多样性的系统策略对于推动未来的突破至关重要。
该研究设计了一种系统的形态因子筛选方法,以探索不同的形态因子如何与前神经TFs一起从PSCs中产生不同类型的神经元。使用高通量单细胞RNA测序(scRNA-seq),该研究分析了480种独特形态形成条件组合中的近70万个细胞。该研究鉴定出与人体相似的多种iN亚型,包括来自前脑、中脑、后脑、脊髓和周围神经系统的神经元。这些iNs还与人类神经元具有相同的特征,即产生谷氨酸、GABA、多巴胺和乙酰胆碱等神经递质。此外,iN亚型的电活动模式的多样性也很明显,这表明它们在功能上是不同的。
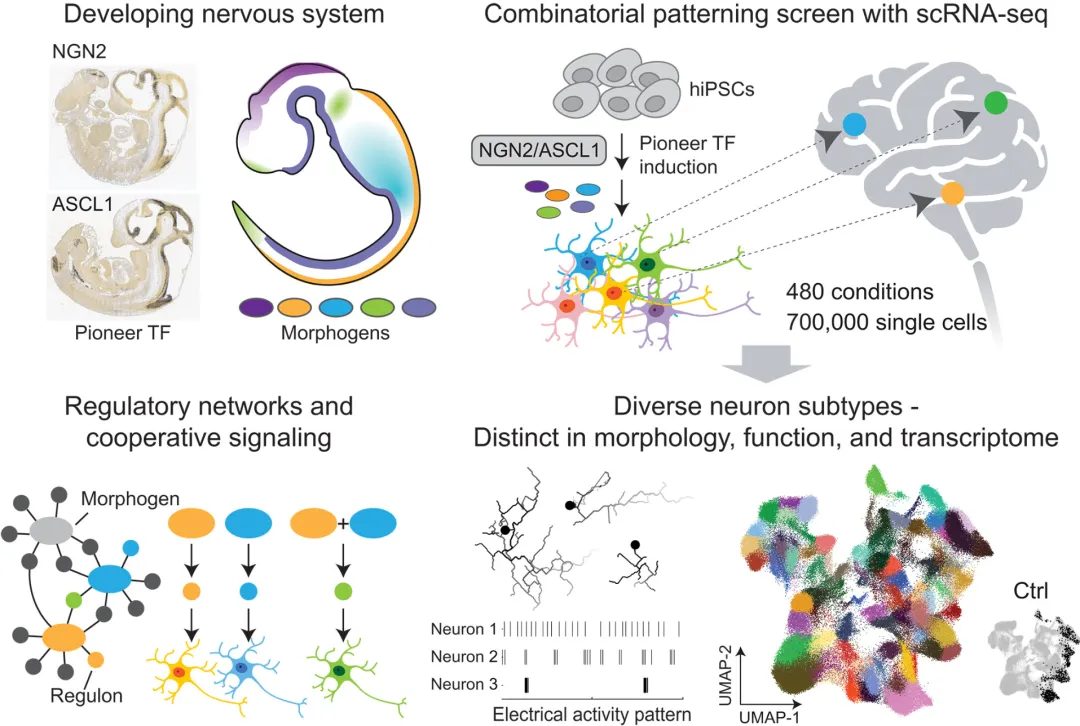
从PSCs结合先锋TFs和参与神经系统发育的形态因子对人类神经元亚型进行编程(图源自Science )
为了了解形态因子如何影响特定iN亚型的形成,该研究使用scRNA-seq数据来推断基因调控网络。该研究确定了关键的TFs及其下游靶基因,统称为调控子,它们被形态因子的组合激活,引导神经元进入特定的亚型。为了验证发现,该研究使用过表达和CRISPR-Cas9敲除等遗传方法来干扰关键的TFs。当关键TFs缺失时,形态形成因子不能再将iNs引导成特定亚型。相反,过表达关键TFs足以驱动没有形态因子的特定iN亚型的形成。该研究还发现,在诱导前神经TFs之前,将PSCs暴露于形态因子可以激活人类神经元中发现的调控,产生更统一、更接近人类初级神经元的iN亚型。
总之,该研究扩大了体外生成的人类iNs的多样性,并揭示了合作信号如何驱动细胞命运获取。该研究确定了指导iN亚型出现的规则,这将使未来特定神经元类型的培养成为可能。该研究的数据集将形态因子与细胞命运结果联系起来,特别适合于预测建模,以推断新条件下的细胞命运。总之,该研究的方法可以推广到神经元以外的各种细胞类型,并具有很大的潜力,可以促进对人类生物学、疾病机制和治疗创新的理解。
https://www.science.org/doi/10.1126/science.adn6121

—END—
版权声明
本文转载“iNature”,版权属于原作者所有,文章翻译和转载为学术传播。
团队水平有限,翻译和转载难免有不恰当之处,请批评指正,多多包涵!
往期精彩回顾:
