让癌细胞“自曝其短”:化学重编程技术如何将肿瘤转化为自身的疫苗?
- 2026-01-11 16:52:58
在癌症免疫治疗学的战场上,癌细胞往往像狡猾的特工。它们一方面通过“隐身”——下调表面抗原,逃避免疫系统的监视;另一方面通过“踩刹车”——高表达PD-L1等检查点蛋白,抑制杀伤性T细胞的活性。这种双重防御机制,使得许多肿瘤在面对现有的免疫疗法时表现为难治性的“冷肿瘤”。
如果我们能拥有一种技术,不仅能强行撕下癌细胞的伪装,还能迫使它们主动向免疫大军“自首”,不仅解除其防御,更将其转化为训练免疫军队的靶子,癌症治疗的格局是否将被改写?
近日,北大研究团队发表在 Nature 上的一项突破性研究 “Intratumoural vaccination via checkpoint degradation-coupled antigen presentation”,提出了一种名为 iVAC 的创新策略。这项技术通过化学手段“重编程”癌细胞,将其转化为抗原呈递细胞,实现了免疫检查点降解(👈一键点击,获取深度解读)与抗原呈递的双重打击。

困境与突围:当“冷”肿瘤遇到免疫逃逸
癌症的生存策略:隐身与防御
当前的癌症免疫疗法面临两大痛点,这主要源于肿瘤微环境(Tumor Microenvironment, TME)的复杂性:
1.抗原呈递缺失:T细胞识别癌细胞依赖于“抗原呈递”。这就像是给免疫细胞查验“身份证”。正常的细胞会将内部的蛋白片段(抗原)展示在细胞表面的MHC分子上。然而,癌细胞常通过下调MHC-I分子或隐藏肿瘤抗原,使自己成为免疫系统无法识别的“隐形人”。
2.免疫抑制:癌细胞表面高表达PD-L1等检查点蛋白。PD-L1就像癌细胞亮出的“免死金牌”,一旦与T细胞上的PD-1结合,就会告诉T细胞“自己人,别开火”。
尽管检查点阻断(Checkpoint Blockade)疗法(如PD-1/PD-L1抗体)已取得巨大成功,但在许多由免疫抑制性微环境主导的“冷肿瘤”中,由于缺乏有效的T细胞浸润和识别,响应率依然有限。
传统疫苗的局限
现有的癌症疫苗试图将抗原递送给专业的抗原呈递细胞(如树突状细胞,DC),由它们来“教育”T细胞。但在肿瘤内部,功能性DC往往非常匮乏。研究团队思考:既然肿瘤内部充满了癌细胞,能否直接改造癌细胞,让它们自己承担起“抗原呈递”的任务?
核心技术解密:iVAC——一石二鸟的化学嵌合体
iVAC的设计美学
研究人员设计了一种名为 iVAC (Intratumoural Vaccination Chimera) 的双功能分子。它并非基因疗法,而是一种基于蛋白质的化学工具,主要由三部分组成:
弹头:靶向PD-L1的共价纳米抗体(GlueBody)。
载体:穿透细胞膜的肽段(CPP)。
弹药:外源性免疫原性抗原(如病毒肽段)。
机制:从防御者到告密者
iVAC进入肿瘤后,执行了一套精密的“特洛伊木马”行动,利用靶向蛋白质降解(Targeted Protein Degradation)机制实现细胞重编程:
核心概念:化学重编程
传统上,细胞重编程(如诱导多能干细胞)多依赖转录因子等遗传学手段,过程漫长且有致瘤风险。本研究展示了化学生物学的力量——利用小分子/嵌合体药物,在蛋白质水平上迅速改变细胞命运和功能,让癌细胞“兼职”做起了免疫细胞的工作。
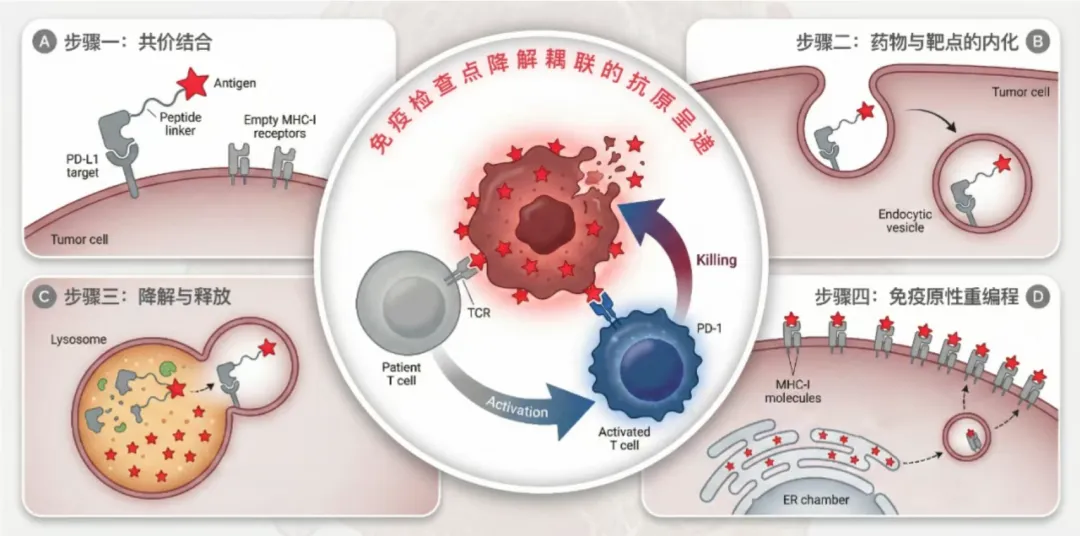
iVAC作用机理图
实验验证:唤醒沉睡的杀手与重塑微环境
1.激活“旁观者”T细胞
肿瘤微环境中往往存在大量“旁观者T细胞”(Bystander T cells)。它们并不识别肿瘤抗原,而是识别流感病毒、CMV(巨细胞病毒)等非肿瘤抗原,因此它们通常在肿瘤里“无所事事”。
iVAC通过强制癌细胞展示病毒抗原(如CMV肽段),成功实现了“借刀杀人”:
iVAC将癌细胞伪装成被病毒感染的细胞。
这激活了体内原本存在的、针对病毒的记忆性T细胞。
这些被唤醒的T细胞转头攻击癌细胞,引发强烈的免疫杀伤。
2. 重塑肿瘤微环境(TME)
实验结果显示,iVAC不仅杀伤了肿瘤,还引发了TME的连锁反应:
炎症因子释放:诱导了IFN-γ和TNF等关键细胞因子的分泌。
细胞招募:促进了树突状细胞(cDC1)的成熟和杀伤性T细胞的浸润。
逆转抑制:减少了调节性T细胞(Treg)和M2型巨噬细胞(抗炎型),将“冷”肿瘤微环境加热为“热”环境。
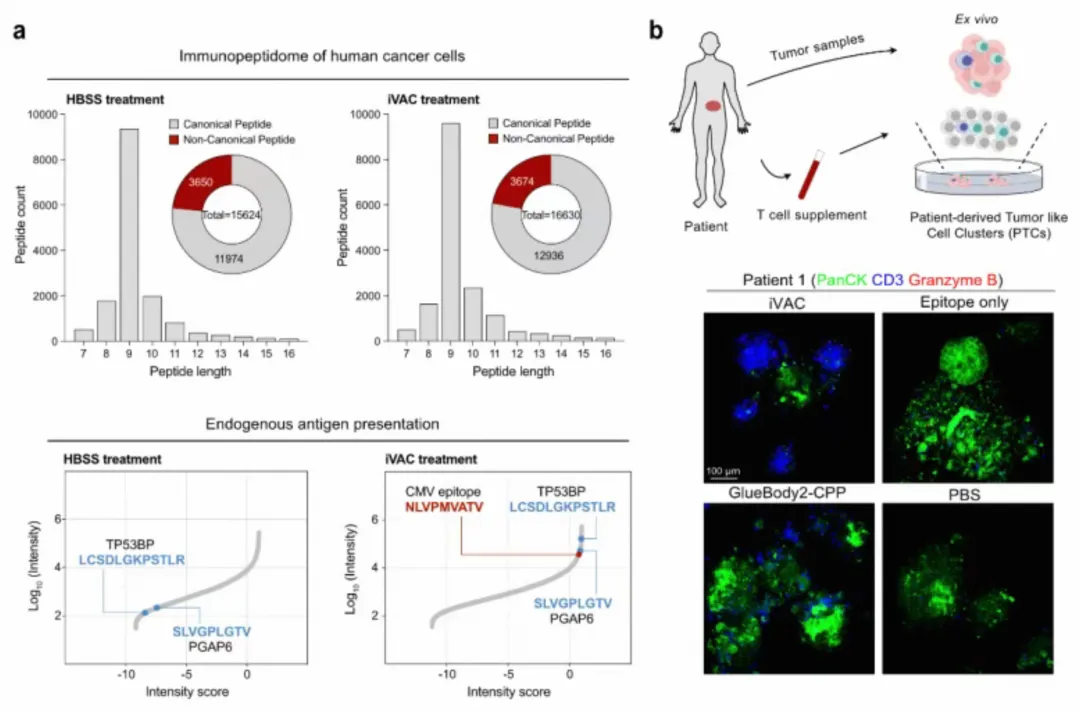
a.瘤内疫苗嵌合体 iVAC 促进人源肿瘤细胞的抗原呈递b.并在面向临床的模型中介导旁观者 T 细胞对肿瘤细胞的杀伤
3. 临床潜力的验证
研究团队利用患者来源的肿瘤类器官(PTC)模型进行了验证。这种模型能高度还原患者的肿瘤特征。
在结直肠癌和肾癌患者的PTC模型中,iVAC展现了显著的疗效。
特别是针对携带常见HLA类型(如HLA-A*02:01)的患者,利用其体内已有的病毒免疫记忆(如针对CMV病毒的记忆),iVAC实现了个性化的精准打击。
开启免疫治疗新纪元
本研究开发了一种非基因层面的化学重编程策略(iVAC),创新性地将免疫检查点降解与外源抗原呈递偶联。它成功将癌细胞转化为“类抗原呈递细胞”,在解除免疫抑制的同时,利用机体既有的病毒免疫记忆,对肿瘤实施精确打击,并实现了持久的抗肿瘤免疫记忆。
未来展望
广谱适用性:iVAC的设计具有模块化特点。针对不同患者的HLA类型和病毒感染史,可以快速更换抗原“弹药”,实现个性化定制。
“冷”肿瘤克星:对于缺乏新抗原、免疫原性低的难治性肿瘤,这种强制展示强免疫原性抗原的策略提供了新的破局思路。
免疫学的“借力打力”:与其苦苦寻找肿瘤特异性新抗原,不如利用人体内强大的抗病毒免疫记忆。这种“借用”旁路T细胞杀伤肿瘤的思路,为连接感染免疫与肿瘤免疫架起了一座桥梁。
这项研究不仅在技术上展示了蛋白质降解技术的巨大潜力,更为我们理解如何通过化学手段操纵免疫系统提供了全新的视角。对于生物医学专业的学生而言,理解这种跨学科(化学生物学+免疫学)的创新思维,是通往未来医学研究的重要一课。

本文由Sciencepedia为您解读。Sciencepedia 由玻尔发起,像是一座正在建设中的“科学星港”,无数知识在此汇聚、流动、闪光。我们相信:再深的科学,也能被讲清;再远的好奇,也值得被回应。
网页版访问 bohrium.com/sciencepedia 直达
